シグナル伝達に関わる三量体Gタンパク質が細胞膜を離れて細胞質にとどまる仕組みを原子レベルで解明
| 原著論文 | Nat Commun 9, 4635 (2018) |
|---|---|
| 論文タイトル | Gip1 structure places G proteins in lockdown |
| 研究室サイト | 1分子生物学研究室〈上田 昌宏 教授〉 |
概要
大阪大学大学院生命機能研究科の上田昌宏教授(理化学研究所生命機能科学研究センターのチームリーダーを兼任)と同大学蛋白質研究所の中川敦史教授らの研究グループは、細胞内のシグナル伝達に関わる三量体Gタンパク質が、細胞膜を離れて細胞質に安定してとどまる仕組みを世界で初めて明らかにしました。
Gタンパク質共役型受容体(GPCR)は既存の薬剤標的の約30%を占める、重要なシグナル伝達タンパク質として知られています。細胞膜に埋め込まれたGPCRが外界の様々な刺激を受けると、三量体Gタンパク質を活性化して、細胞内へと刺激情報を伝えます。この三量体Gタンパク質は、自身に結合した疎水性の脂質分子(脂質修飾)が細胞膜に刺さることで細胞膜表面に局在しますが、その一部は細胞膜を離れて、細胞の内部(細胞質)にも存在しています。研究グループは2016年に世界に先駆けて、親水性の細胞質に三量体Gタンパク質をとどめる機能をもつGip1タンパク質を発見しましたが、その働きの詳しい仕組みはわかっていませんでした。
今回、研究グループは大型放射光施設SPring-8を利用してGip1の立体構造の決定に成功し、Gip1が三量体Gタンパク質の脂質修飾部位を覆い隠すことで、Gタンパク質が細胞質内でも安定に存在できることを解明しました(図1)。
今回の発見は、GPCRシグナル伝達の基礎研究に新たな視点を与えると共に、創薬に繋がるような医科学分野への貢献も期待されます。
研究の背景
細胞は外部からの刺激を感知して、細胞内でシグナルを伝達・処理し、適切な応答をとることができます。細胞の内と外を隔てるものは脂質で構成された細胞膜です。膜にはGPCRなどの受容体タンパク質が膜を貫くように埋まっており、細胞外にある特定の物質と受容体が結合することからシグナル伝達がスタートします。三量体Gタンパク質は、細胞膜表面でGPCRからのシグナルを受け取り細胞内に伝達するタンパク質です。このタンパク質は、脂質修飾により疎水的性質が付与されることで細胞膜表面に局在しています。
2016年に研究グループは、単細胞アメーバである細胞性粘菌や細胞分化を研究する上でのモデル生物として用いられている。">において三量体Gタンパク質の一部が親水性の細胞質に存在していることを見出し、三量体Gタンパク質を細胞質にとどめる機能をもつ分子としてGip1タンパク質を同定しました。粘菌細胞は、外部の誘引性化学物質を10万倍程度の広い濃度領域に渡って認識し、濃度勾配の低いところから高いところまで効率的に走化性運動をすることができますが、Gip1を欠損した粘菌細胞では高濃度の誘引物質を感知できないこともわかりました。つまり、Gip1の働きにより三量体Gタンパク質が細胞膜と細胞質を行き来することが、粘菌細胞の誘引物質の感知と走化性運動にとって重要という意外な結果が得られました。
Gip1は三量体Gタンパク質と結合して細胞質にとどめるために必須の分子ですが、三量体Gタンパク質とどのような相互作用をして、疎水性の高い脂質修飾部位をもつGタンパク質を親水性の環境である細胞質に安定して存在させるのかは謎でした。
本研究の成果
今回、研究グループがX線結晶構造解析法によりGip1の立体構造を決定したところ、Gip1はカゴ状構造をとり、中央に疎水性の穴が空いていることがわかりました(図2)。穴の中には脂質分子も確認されたことから、Gip1が三量体Gタンパク質の脂質修飾部位を覆っている可能性が示唆されました。
さらに、遺伝子操作により、穴を塞いだGip1変異体と脂質修飾されない三量体Gタンパク質変異体とを作製して両者の相互作用を調べたところ、どちらの変異体タンパク質も本来のGip1・三量体Gタンパク質複合体を形成できなくなりました(図3)。Gip1と三量体Gタンパク質が結合できないこれらの変異遺伝子を導入した粘菌細胞は、Gip1を欠損した細胞と同様に、細胞質中に三量体Gタンパク質が観察されず、高い誘引物質濃度領域での走化性効率も落ちていました。つまり、Gip1は穴を介して三量体Gタンパク質と結合することで正常に機能し、粘菌細胞が高濃度の誘引物質に対して効率的に走化性運動をするために重要であることがわかりました。
また、今回の研究では、Gip1の立体構造を2種類明らかにしました。この2種類の全体構造はほぼ同じですが、Gip1の一部が内部に押し込まれて疎水性の穴がへこみ、穴の大きさに違いが出ていました。以前の観察から、細胞外の誘引物質刺激によって三量体Gタンパク質はGip1から離れ、細胞質から細胞膜へとその居場所を変えることがわかっていました。おそらく、Gip1は細胞外からの刺激があると、穴の大きさを変化させることで、三量体Gタンパク質との結合の強さを調節しているのではないかと予想されます。
以上の結果は、カゴ状のGip1に空いた疎水性の穴が三量体Gタンパク質の脂質修飾部位を覆い隠し、Gタンパク質の疎水的性質を抑えることで細胞膜表面から解離させるというモデルを強く示唆しています。
研究成果のポイント
- Gip1が三量体Gタンパク質の脂質修飾部位を覆い隠すことで、三量体Gタンパク質が細胞質内でも安定に存在できることを解明
- これまでGip1の構造と働きの詳しい仕組みはわかっていなかった
- 三量体Gタンパク質は多くの細胞シグナル伝達に関わっており、基礎研究ばかりでなく新たな薬剤開発へと繋がる可能性を持つ成果
本研究成果が社会に与える影響(本研究成果の意義)
これまで三量体Gタンパク質の活性制御は、GPCRによるGDP/GTP交換反応とGTPase活性を中心に考えられてきました。本研究成果により、従来から知られている活性調節とは異なり、脂質修飾を介して三量体Gタンパク質の細胞内での所在を変えるという、新しい調節メカニズムの構造基盤が明らかになりました。Gip1の立体構造と似たタンパク質はヒトにも存在しています。Gip1を介した三量体Gタンパク質の制御メカニズムは粘菌細胞のみならずヒトの細胞でも発見されるかもしれません。これまでなかった新規の作用機序による創薬開発につながることも期待されます。
特記事項
本研究成果は、2018年11月6日(火)19時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。なお、本研究は、日本学術振興会(JSPS)科学研究費助成事業の科学研究費補助金 基盤研究(C)(17K07396)、若手研究(B)(17K15105)、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」(研究開発総括:横山信治)における研究開発課題「1分子・質量イメージング顕微鏡の開発と細胞膜機能解析」(研究開発代表:上田昌宏)(JP18gm0910001)の一環として行われました。
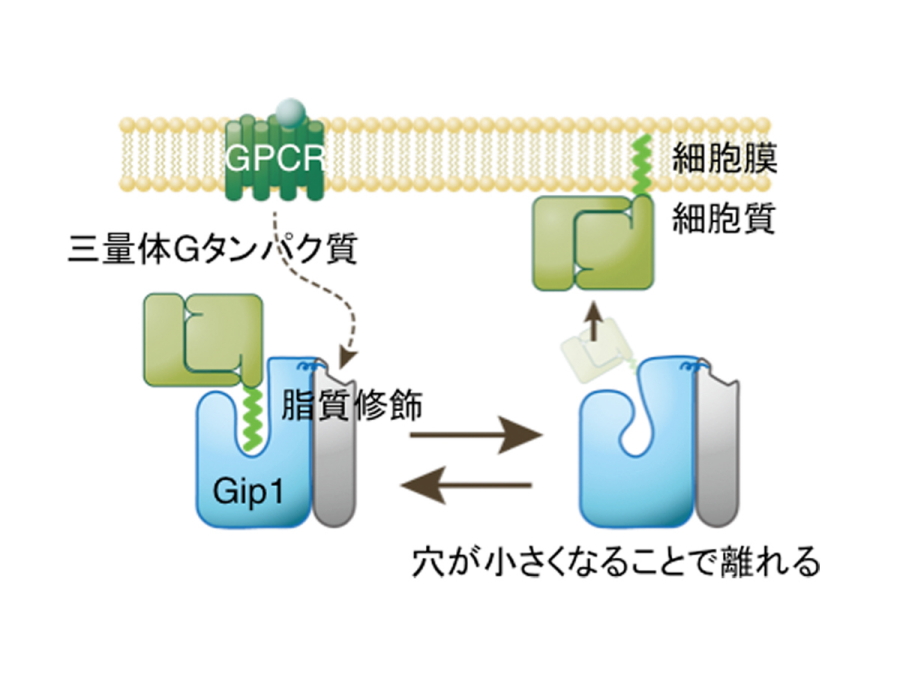
図1.三量体Gタンパク質がGip1により細胞質に保持される仕組み。
Gip1(水色)の疎水性の穴の中に三量体Gタンパク質(黄緑色)の脂質修飾がはまり、覆い隠すことで、Gタンパク質を膜から隔離する。
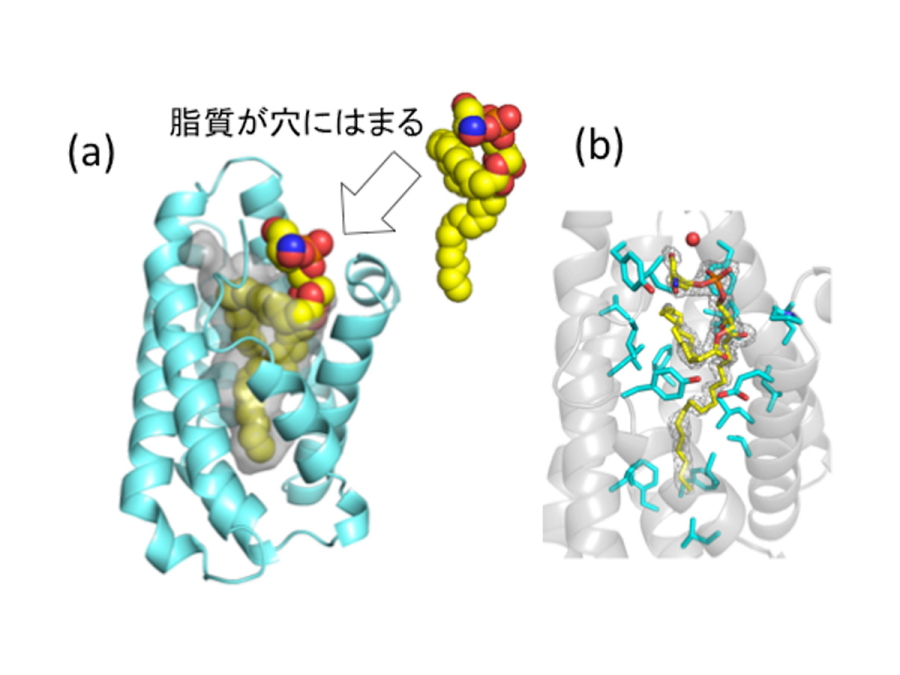
図2.
(a)Gip1の三次元立体構造。カゴ状のGip1(水色)の中央には疎水性の穴が空いており(穴の表面を灰色)、脂質分子(黄色)がはまっている。(b)穴を構成するアミノ酸(水色)と穴にはまっている脂質(黄色)。表示しているアミノ酸のほとんどは、電気的な極性をもたない疎水性アミノ酸である。
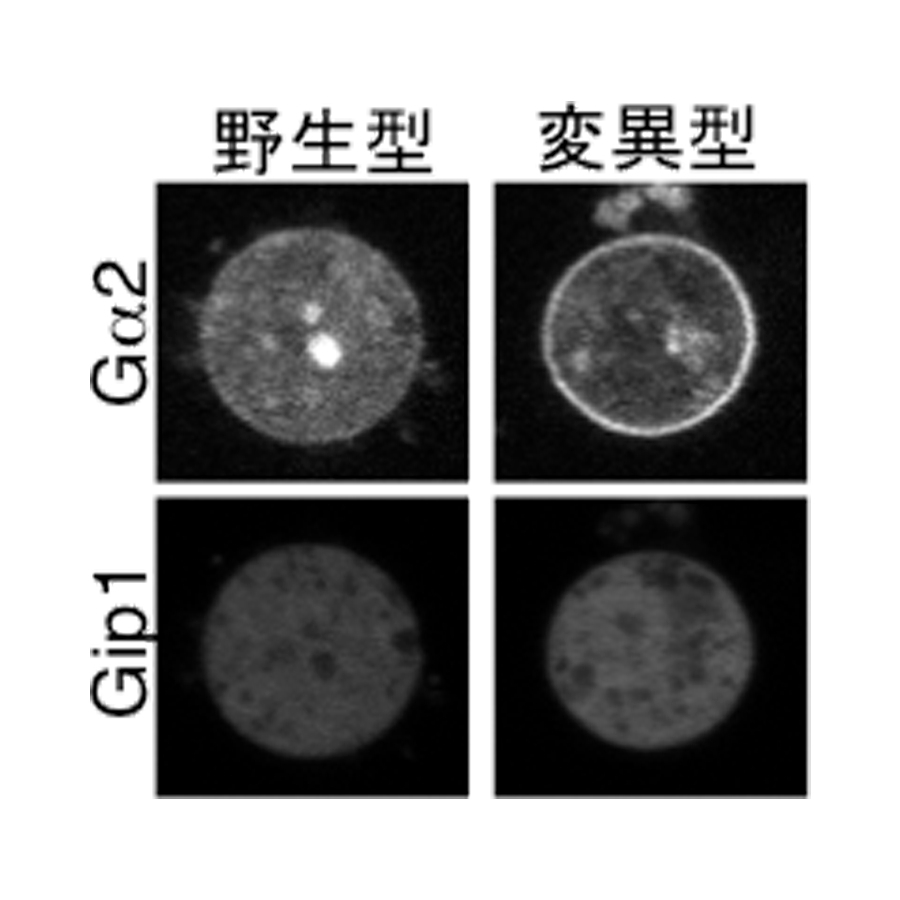
図3.
粘菌細胞内での三量体Gタンパク質(Gα2)の局在。野生型Gip1を発現した細胞では、Gタンパク質は細胞膜(細胞のふち)と細胞質(細胞内部)で観察される。一方、穴を塞いだ変異型Gip1を発現した細胞では、Gタンパク質は細胞膜でしか観察されない。つまり、Gip1が正常にはたらくと三量体Gタンパク質は細胞質にとどまることができる。
用語解説
- 三量体Gタンパク質
低分子のGDPが結合しているαサブユニットと、β、γサブユニットの三分子からなる、細胞膜表面に存在して機能するタンパク質。GPCRなどからの刺激によりαサブユニットのGDPとGTPが交換されることで活性が調節され、下流分子にシグナルを伝えるか否かが決まる。 - Gタンパク質共役型受容体(GPCR)
細胞膜に存在する代表的な受容体タンパク質であり、細胞外部分でシグナル分子と結合すると、細胞内部分の構造が変わり、三量体Gタンパク質を活性化する。ヒトではおよそ800種類のGPCRが存在しており、様々な生命現象に関わっていることから、重要な薬剤ターゲットとなっている。 - 脂質修飾
疎水的な性質を持つ脂質分子がタンパク質と結合することで、タンパク質に疎水的性質を付加する。この修飾は、主にタンパク質を膜に局在させるために利用される。 - 細胞性粘菌
土壌中に生息する単細胞アメーバ。普段は単細胞生物として振舞うが、餌がなくなると細胞同士で集合して多細胞体となる。走化性運動や細胞分化を研究する上でのモデル生物として用いられている。 - 走化性運動
細胞が外部の誘因物質などの化学物質の濃度勾配を感知し、その勾配に沿って移動する性質のこと。白血球など免疫細胞が病原体を追跡し捕食する現象や、受精卵から個体が発生する現象など、様々な生命現象に関わっている。 - X線結晶構造解析法
タンパク質を特定条件下で結晶化し、その結晶にX線を照射することで回折像を得て、そこからタンパク質の三次元立体構造を決定する手法。
| 原著論文 | Nat Commun 9, 4635 (2018) |
|---|---|
| 論文タイトル | Gip1 structure places G proteins in lockdown |
| 著者 | Miyagawa T (1, 2), Koteishi H (2, 3), Kamimura Y (2), Miyanaga Y (1), Takeshita K (5, 6), Nakagawa A (5), Ueda M (1, 2)
|
| PubMed | 30401901 |
