がん細胞を効果的に死滅させる標的分子の発見
染色体の整列機構の解明から
| 原著論文 | Cell Reports, 116515 (2025) |
|---|---|
| 論文タイトル | KIF18A promotes chromosome congression in cooperation with CENP-E downstream of CENP-C |
| 研究室サイト | 染色体生物学研究室〈深川 竜郎 教授〉 |
概要
大阪大学大学院生命機能研究科の繆嘉航さん(ミョウカコウ)(研究当時博士後期課程、現在同特任研究員)、原昌稔助教(研究当時、現在東京大学准教授)、深川竜郎教授らの研究グループは、マサチューセッツ工科大学のイアン・チーズマン博士との共同で、染色体の整列に関わる新しい分子機構を世界で初めて明らかにしました。特にKIF18AとCENP-Eという2種類のタンパク質が、正常な染色体の整列に関与することを見い出しました。また、CENP-Eの量が少ないがん細胞では、KIF18Aの機能阻害によって、がん細胞が効率的に死滅することも明らかにしました。
染色体が次世代の細胞に正確に分配されることは、生命の維持にとって極めて重要です。細胞の両極から伸びた微小管が染色体上に形成される動原体を捉え、牽引することで染色体の分配がおきますが(図1)、正確な染色体の分配に失敗すると「がん」を始めとする多くの疾患を引き起こすことが知られています。これまで、染色体の分配機構を解明する目的で動原体の構造や微小管結合機能などが詳細に調べられており、動原体は100種類を超えるタンパク質が複雑に相互作用して機能していることが明らかになっています。同じ機能を持つ複数のタンパク質が関与するために、動原体中には見過ごされた分子機能が複数あると考えられていましたが、適切な実験系が存在しないためにそのような分子機能は見過ごされたままとなっていました。 今回、研究グループは、動原体の一部の機能が失われた独自の変異体細胞(CENP-C変異細胞:図2)を用いて、全ゲノム遺伝子破壊スクリーニングを行い、KIF18Aタンパク質の破壊によって、正常細胞は死滅しないものの、変異体細胞は死滅することを見出しました。 研究グループは、さらに詳しく複数の「がん細胞」を解析し、KIF18Aの機能阻害で死滅する「がん細胞」では、CENP-Eの量が少ないことを見出し、KIF18AとCENP-Eが協調して染色体の整列に関与し、その両方の阻害で細胞死をおこすという分子機構を明らかにしました(図2)。
このことから、KIF18AとCENP-Eの2種類のタンパク質の機能阻害を併用することで、より効果的な抗がん剤のドラッグデザインが期待されます。
研究の背景
生物のすべての遺伝情報(ゲノム)は、染色体と呼ばれる構造体に包まれ、次世代の細胞に伝達されていきます(図1)。そのため、染色体の次世代細胞への正確な分配は、生命を維持する上で必須ですが、染色体の分配に問題がおこると、細胞には多くの異常を生じます。この異常は、「がん」を始め、多くの病気の原因になることが知られています。したがって、染色体が正確に次世代の細胞へ分配されるしくみを解明することは、染色体異常が原因で起こる病気(がんやダウン症など)の発症機構の解明や抗がん剤の開発などのドラッグデザインにも貢献します。
これまでに、染色体が分配されるしくみを理解するために、紡錘体微小管が動原体とどのように結合するのかについて多くの研究が行われてきました。特に、動原体がどのようなタンパク質で構成されているのかについては、詳細な研究がされています。その研究の結果、動原体は100種類を超えるタンパク質が複雑に相互作用して機能していることが明らかになってきました。おそらく、正確に染色体分配を行うためには、同じ機能を行うタンパク質が複数存在し、一つのタンパク質に異常が起きても、他のタンパク質の機能によって異常をバックアップするような機構が必要と考えられます。しかし、機能解析の面から考えると、一つのタンパク質機能を失わせても、表現型がはっきりと出ないために機能解析が遅れています。
本研究の成果
上記のような背景があるために、研究グループでは、動原体機能の一部が失われた独自の変異体細胞(CENP-C変異細胞:図2)に注目しました。これまでの研究で、この変異体細胞では、CENP-Cという動原体構成タンパク質と他のタンパク質の結合が弱くなっていることが明らかになっていました。また、この変異体細胞は生育するものの、やや分配が遅れること、またこの変異体細胞をもつマウスでは「がん」になりやすいことをつきとめていました。
今回、この変異体細胞とクリスパー・キャスナインを活用した全ゲノム遺伝子破壊スクリーニングを行いました。これによって、遺伝子破壊によって正常細胞は死滅しないけれども、この変異体細胞を死滅させるような遺伝子をヒト全遺伝子から探しました。その結果、KIF18Aタンパク質遺伝子の破壊によって、正常細胞は死滅しないものの、この変異体細胞は死滅することを見出しました(図2:最右カラム)。
KIF18Aは、微小管の先端に局在するモータタンパク質で、これまでは、染色体分配の後期に機能することが提唱されていましたが、本研究の詳細な表現型の解析から染色体分配の初期段階である染色体の整列に関わることが明らかになりました。また、この染色体整列には、CENP-Eという別のモータタンパク質と協調して働くことも明らかになりました。研究グループがスクリーニングに用いたCENP-Cの変異体細胞では、CENP-Eの機能が低下しており、KIF18Aの遺伝子破壊では、CENP-EとKIF18Aの両方が働かないので死滅することがわかりました(図2最右カラム)。一方で、正常細胞ではKIF18Aを破壊してもCENP-Eが機能するので、染色体が整列して細胞は死滅しないということになります(図2:3番目のカラム)。
KIF18Aは、現在抗がん剤のターゲットとして注目されているのですが、KIF18Aの阻害によって死滅する「がん細胞」とKIF18Aの阻害によって死滅しない「がん細胞」があることが知られていました。研究グループは、さらに複数のがん細胞を解析し、KIF18Aの機能阻害で死滅するがん細胞では、CENP-Eの量が少ないことを見出しました。 このことから、がん細胞を効果的に死滅させるには、CENP-EとKIF18Aの両方の機能阻害が重要であることがわかりした(図2最右カラム)。また、抗がん剤としての使用が期待されるKIF18Aの阻害は、CENP-Eの量の少ないがん細胞で効果的なので、CENP-Eの量をモニターしながらのKIF18Aの阻害も有効と言えます。
研究成果のポイント
- KIF18AとCENP-Eという2種類のモータータンパク質が協調して細胞分裂初期のイベントである染色体の整列に関わることを解明
- さらなる解析により、CENP-Eの量が少ないがん細胞では、KIF18Aの機能阻害によって効果的にがん細胞を死滅させることを証明
- 染色体分配の詳細なメカニズムを解明しただけでなく、効果的な抗がん剤のドラッグデザインにつながることが期待される研究成果
本研究成果が社会に与える影響(本研究成果の意義)
KIF18Aの阻害に関しては、現在多くの研究者が注目していますが、本研究からCENP-E阻害との併用が有効であることが判明したので、2つの阻害剤を組み合わせた、効果的な抗がん剤の創薬が期待されます。
研究者のコメント
我々は、基礎科学として染色体の分配機構の解明を目指して研究を行っていますが、今回は、染色体分配の詳細なメカニズムの解明だけでなく、その成果についてがん細胞を効率的に死滅させる方法にも応用しました。がん細胞だけを特異的に死滅させる技術は期待されていますが、基礎研究に裏付けされていなければなりません。今後も基礎研究の知見を、がん研究に応用できるような研究を行いたいと思っています。(深川竜郎)
特記事項
本研究成果は、2025年11月11日(火)時(日本時間)に米国科学誌「Cell Reports」(オンライン)に掲載されました。
なお、本研究は、マサチューセッツ工科大学のイアン・チーズマン教授との共同で行われました。また、以下の研究費の支援によって行われました。
- JST戦略的創造研究推進事業CREST「動原体超分子複合体の構造ダイナミクス」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
- 科学研究費補助金 学術変革領域(A)クラスター細胞学「バイオロジカルクラスターを介した機能的動原体の形成機構」計画研究(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
- 科学研究費補助金 基盤研究(A)「セントロメア多様性の解析を通じたセントロメア形成機構の本質的理解(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
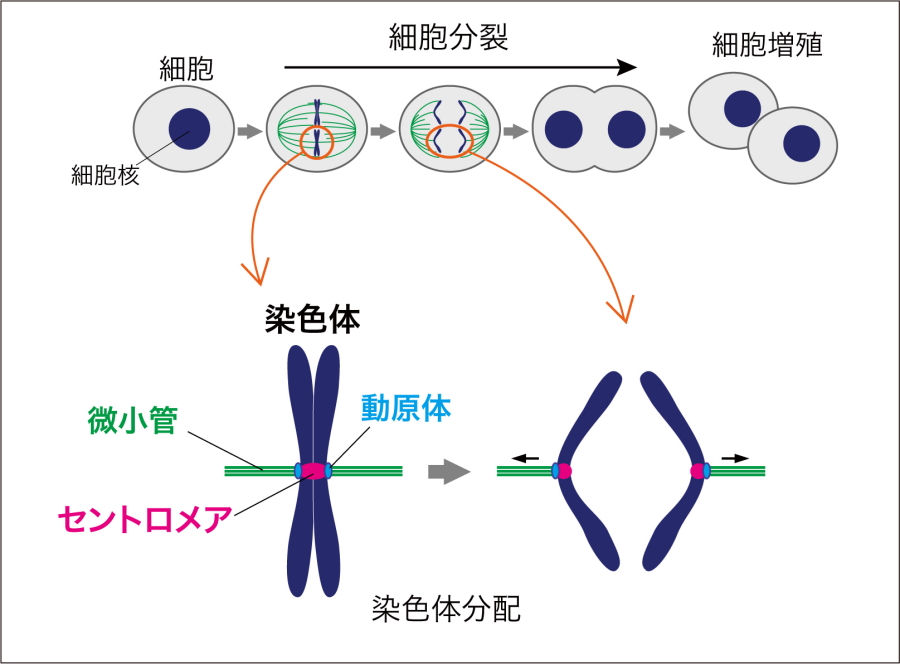
図1.染色体分配の模式図
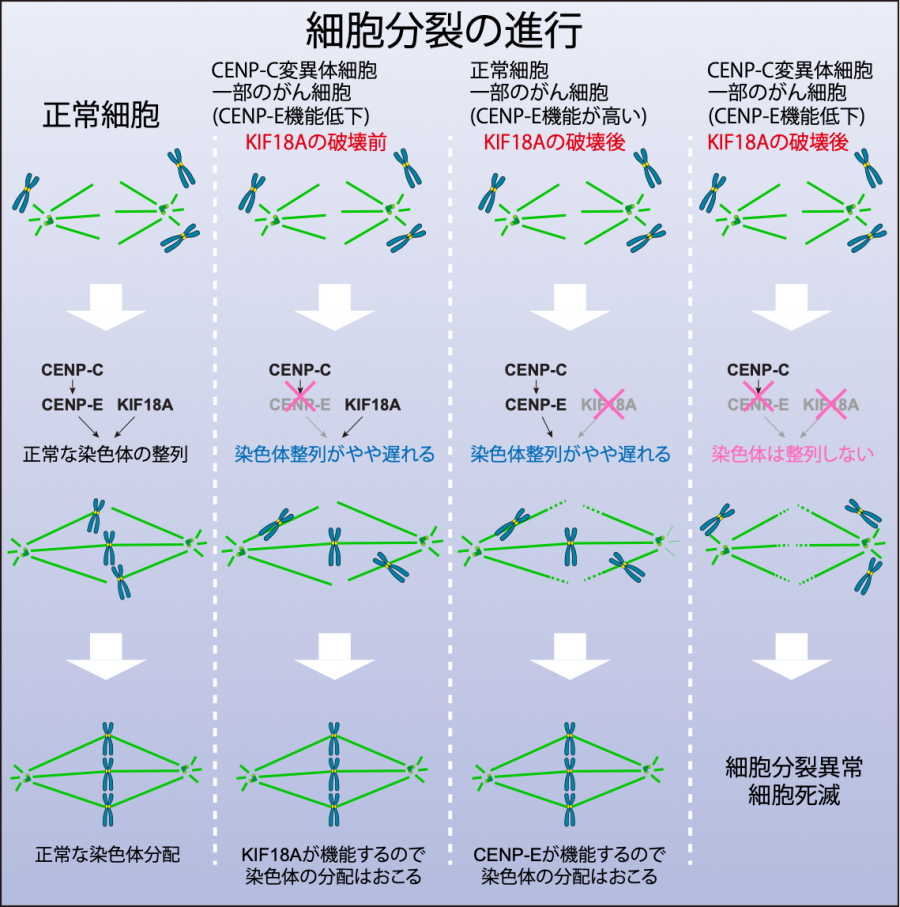
図2.
本研究の要約。左:正常細胞、左から2番目:CENP-E機能がやや低下した細胞。この細胞では染色体整列がやや遅れるが、生育か可能。左から3番目:正常細胞やCENP-Eの機能が十分ながん細胞。これらの細胞ではKIF18Aの機能破壊で細胞は死なない。右:左から2番目の細胞。これらの細胞にKIF18Aの機能破壊を行うと細胞は死滅。
用語解説
- 染色体の整列
染色体の整列とは、細胞分裂における染色体分配(下記参照)の初期のイベントである。複製された染色体が細胞の中央部(赤道面)に集まり、正確な位置に並ぶ現象を指す。この整列は紡錘体微小管と呼ばれる装置により行われ、動原体と微小管の結合によって染色体は赤道面に整列する。すべての染色体が正しく整列することで、後期の染色体分配が起き、染色体は正確に娘細胞へ分配される。 - KIF18A
KIF18Aはキネシン-8ファミリーに属するモータータンパク質(下記参照)。微小管上をプラス端に向かって動くモーター活性と共に、微小管のプラス端特異的に重合を抑制する活性をもつという特徴があり、多様な機能が想定されているが、染色体分配での機能に関しては不明な点が多い。ただし、抗がん剤の分子標的として注目されている。 - CENP-E
CENP-Eはモータータンパク質(下記参照)の一種であり微小管のプラス端と動原体に局在する。染色体の整列に関与することが、報告されている。 - 動原体
染色体上のセントロメア領域に形成される巨大なタンパク質複合体。細胞分裂が起こるとき、染色体を引っ張る糸(微小管)と結合し、染色体と微小管との結合を仲介することで染色体分配の過程で重要な働きをする。 - 染色体分配
細胞には、遺伝情報を含んだ染色体が複数本存在する。これら染色体は、細胞が分裂して増える前に2つにコピーされ、細胞分裂にともない次世代の細胞に分けられなければならない。このコピーされた染色体を子孫の細胞へ均等に受け渡すことを染色体分配という。(図1) - 全ゲノム遺伝子破壊スクリーニング
ゲノム上の全ての遺伝子を標的とする、多数のガイドRNA(gRNA)を含むクリスパーライブラリ-を用意して、そのgRNAを1細胞ずつに導入する。その結果、各細胞において一つの遺伝子が破壊された状態になる。それぞれの細胞の増殖を解析して、各遺伝子の破壊による増殖の程度を評価できる。 - クリスパー・キャスナイン
CRISPR・Cas9(クリスパー・キャスナイン)とは、DNAの二本鎖切断を原理とする遺伝子改変ツールで、標的のガイドRNA(gRNA)を利用して部位特異的にゲノム領域を切断できる。この方法で、遺伝子の機能欠損(ノックアウト)ができる。 - モータータンパク質
モータータンパク質とは、細胞内でアデノシン三リン酸(ATP)をエネルギー源とし、細胞骨格の上を移動しながら物質を輸送したり、細胞運動を引き起こしたりするタンパク質の総称。微小管を移動するキネシンもそのひとつであり、KIF18AもCENP-Eもキネシンに属するモータータンパク質である。
| 原著論文 | Cell Reports, 116515 (2025) |
|---|---|
| 論文タイトル | KIF18A promotes chromosome congression in cooperation with CENP-E downstream of CENP-C |
| 著者 | Jiahang Miao (1), Masatoshi Hara (1, 2), Kuan-Chung Su (3), Heather R. Keys (3), Weixia Kong (1), Yusuke Takenoshita (1), Iain M. Cheeseman (3, 4), Tatsuo Fukagawa (1)
|
