妊娠中の鉄不足がマウス胎仔のオス化を阻害
性決定における鉄の役割を解明
| 原著論文 | Nature 643(8070):262-270 (2025) |
|---|---|
| 論文タイトル | Maternal iron deficiency causes male-to-female sex reversal in mouse embryos |
| 研究室サイト | エピゲノムダイナミクス研究室〈立花 誠 教授〉 |
概要
大阪大学大学院生命機能研究科の岡下修己助教と立花誠教授の研究グループは、ほ乳類における性決定に、鉄代謝がエピゲノム制御を通じて中心的な役割を果たすことをマウスモデルにより明らかにしました。
ヒストンH3の9番目のリジンのジメチル化(H3K9me2)は遺伝子発現の抑制のエピゲノムです。胎仔生殖腺のオス化(精巣化)を担う性決定遺伝子Sryの発現には、H3K9me2の脱メチル化が必要であり、その酵素活性にはFe2+が必須であることが知られています。本研究では、鉄取り込み経路やFe2+産生経路がオス化しようとしている生殖腺で活性化していること及び、この経路を抑制するとSryの発現が抑制されてオスからメスへの性転換が起きることを示しました。また、母体の鉄摂取不足が胎仔の性決定に影響を与えることを実証し、妊娠中の栄養状態が胎仔発生に与える影響を明らかにしました。
本研究は、鉄代謝がエピゲノム制御を介してほ乳類の性分化に影響を及ぼすことを明らかにしました。鉄−エピゲノム−発生・分化という新たな連関軸が提起されたことは、性決定のみならず、他の器官形成や細胞系譜決定過程における鉄代謝の役割を再評価する契機となることが期待できます。
研究の背景
ほ乳類における性決定は、発生初期において生殖腺が精巣あるいは卵巣へと分化することが重要な過程であり、その開始にはY染色体上に存在する精巣決定遺伝子Sryの一過的な活性化が不可欠です。このSryの発現は、発生時期・発現細胞・量ともに極めて厳密に制御されており、少しのずれでも性分化に影響を与えるすことが知られています。Sry遺伝子の発現は、クロマチン状態に依存するエピゲノム制御によって調節され、特にH3K9me2の脱メチル化が転写活性化の鍵を握ります。研究グループはこれまでに、ヒストン脱メチル化酵素KDM3Aがこの脱メチル化反応を担い、Sryの発現を活性化することを報告してきました。
一方で、KDM3AをはじめとするJmjCドメインをもつヒストン脱メチル化酵素群の活性は、補因子としてFe2+を必須とすることが知られています。しかし、発生期における鉄代謝が性決定やエピゲノム制御にどのように関与しているかについては、これまで分かっていませんでした。本研究では、鉄代謝とKDM3A依存的なSry活性化の関係に着目し、マウスモデルを用いてその因果関係を多角的に検証しました。
本研究の成果
本研究ではまず、マウスの性決定期(E10.5〜E12.5)における胎仔の生殖腺において、鉄の取り込み因子(Tfrc、Scara5)およびFe2+産生因子(Slc11a2、Steap3、Ncoa4、Hmox1)の発現が、Sryを発現する雄性支持細胞(プレセルトリ細胞)で特異的に高いことを、RT-qPCR解析およびscRNA-seqデータの再解析から明らかにしました。さらに、蛍光プローブを用いたFe2+の可視化やICP-MS解析による測定により、これらの細胞では実際にFe2+の蓄積レベルが高いことも確認できました。これらの結果から、Fe2+を補因子とするヒストン脱メチル化酵素KDM3Aが、オス化の性決定において機能するためには鉄の十分な供給が不可欠なのではないかという仮説を立てることができ、そのことを検証する一連の解析を行いました。
Fe2+の細胞内への取り込みを担うTfrc(トランスフェリン受容体)を、生殖腺から特異的に欠損させたマウスを用意しました。そのマウスの胎仔では、性決定期の生殖腺で細胞内のFe2+と総鉄量が著しく低下しており、H3K9me2の増加、Sryの発現低下が確認できました。また、ChIP-qPCR解析により、Sry遺伝子座でのヒストンH3K9me2脱メチル化が著しく阻害されていることが確認され、一部のXY個体においてオスからメスへの性転換が確認できました。これらの結果は、TFR1を介した鉄取り込みがKDM3AによるSry活性化に不可欠であることをマウスの生体内で実証するものでした。
次に、体外培養系を用いて、胎生(E)10.8胚由来の生殖腺を鉄キレート剤デフェロキサミン(Dfo)存在下で培養することで、Fe2+を急性に除去した条件での性決定を検討しました。Dfo処理下でも生殖腺の細胞数に大きな影響はなかったものの、Fe2+と細胞内における鉄の貯蔵に関わるフェリチンの量は大きく低下し、Sry発現が著しく抑制されていることが分かりました。その結果、XY生殖腺におけるSOX9(精巣の体細胞マーカー)の発現が失われ、FOXL2(卵巣の体細胞マーカー)陽性細胞が出現するなど、オス化の抑制とメス化の亢進が生じました。Sryを強制的に発現させるとこの性転換が回避できたことから、鉄欠乏による性転換の原因はSry発現の抑制にあることが分かりました。加えて、Dfo処理によりH3K9me2が顕著に蓄積し、Sryプロモーター領域での脱メチル化が阻害されていることも示されました。さらに、EHMT1/2(H3K9メチルトランスフェラーゼ)の機能を遺伝学的(Ehmt1Δ/+)または薬理学的(RK-701)に阻害することで、Dfo処理下でもSryの発現が部分的に回復することが示されました。このことから、鉄欠乏による性決定破綻はKDM3AとEHMT1/2のH3K9me2修飾のバランスの破綻によるものであることが分かりました。
続いて、妊娠マウスに鉄キレート剤デフェラシロクス(Dfx)を投与し、子宮内での急性鉄欠乏モデルを構築しました。E6.5〜E10.5にかけて母体にDfxを経口投与したところ、E11.5胎仔の生殖腺でSry発現が有意に低下していることが分かりました。こちらの実験に関しても、XY胎仔でSOX9陽性細胞とFOXL2陽性細胞が混在した卵精巣化が起きており、一部の個体で性転換が起きていました。この結果は、母体の鉄状態が胎仔の性決定に直接影響を及ぼしうることを示す強力な証拠です。
最後に、より生理的な鉄欠乏モデルとして、妊娠前から母体に鉄欠乏食を与える長期モデルを用いました。この条件のみでは性転換は生じませんでしたが、Kdm3aヘテロ欠損(Kdm3aΔ/+)という遺伝的背景と組み合わせることで、一部のXY胎仔においてSry発現の低下、H3K9me2の蓄積を伴う、性転換が引き起こされることを確認しました(図2)。これにより、母体の栄養状態と遺伝的背景が相互作用することで、胎仔生殖腺の性決定に破綻が生じる可能性があることが明らかとなりました。
以上の一連の結果は、Fe2+の生体内レベルがヒストン修飾酵素KDM3Aの活性を支え、それによってSryの転写活性が保証されるという代謝―エピゲノム連関の存在を示し、ほ乳類の性決定における鉄代謝の根幹的役割を明確にしました。
研究成果のポイント
- マウスモデルにより鉄(Fe2+)がオス化性決定遺伝子Sryの活性化に重要な役割を担うことが明らかに
- 発生期の鉄代謝が性決定やエピゲノム制御にどのように関与しているかについてはこれまで分かっていなかった
- マウスモデルを用いた遺伝子操作と鉄欠乏実験により、鉄取り込み経路やFe2+産生経路がオス化しようとしている生殖腺で活性化していることや、この経路を抑制するとSryの発現が抑制されて精巣形成の阻害やオスからメスへの性転換が起きることを確認
- 鉄代謝とエピゲノム修飾の連携がほ乳類の性決定に重要であるという新たな概念を提示し、性決定を超えて多様な発生異常や疾患の解明への貢献に期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究は、これまで見過ごされがちだった「母体の栄養状態」が、胎仔の発生運命に重大な影響を与えうることを、性決定という最も基本的な発生プロセスの一つにおいて示した点で、重要な意義を持ちます。妊娠中の鉄欠乏は世界中で数億人規模の女性に影響を及ぼしている公衆衛生上の問題となっているため、大きな問題提起になると考えられます。ただし、本研究の結果が直接ヒトに当てはまるかどうかについては今後慎重に検証していく必要があります。 鉄を必須補因子とするエピゲノム関連酵素はKDM3A以外にも沢山存在します。それらの酵素群は、神経系や造血系など他の発生プロセスにも広く関与しており、本研究が示した「鉄とエピゲノムの連携」という概念は、性決定を超えて多様な発生異常や疾患の解明にも波及的に貢献する可能性を秘めています。
研究者のコメント
代謝は生理的状態や外部環境の影響を非常に受けやすいため、発生過程における鉄の役割を厳密に評価するには高度なタイミング制御と多層的な解析が求められました。特に胎仔の性決定期における鉄の動態を捉えることは容易ではなく、今回の成果はその難しさを乗り越えて得られたものです。一方で、ヒトにおける性決定のメカニズムは依然として多くの点で未解明であり、今回マウスで示された「母体の鉄欠乏が性決定に影響を及ぼす」という知見を、直ちにヒトに当てはめることはできません。今後、ヒトにおける性決定の仕組みのさらなる解明が必要です。ただし、母体の鉄欠乏と胎児の神経発達異常(たとえば自閉症スペクトラム)との関連を示すコホート研究も報告されており、妊娠中の栄養状態が胎児のエピゲノムや発達に及ぼす影響は無視できません。鉄に限らず、葉酸やビタミンB群など他の栄養素もエピゲノム修飾に関わっていることが知られています。今回の研究を通じて、妊娠中の栄養管理が胎仔の健全な発達において極めて重要であるというメッセージを、改めて強調したいと考えています。(岡下修己)
特記事項
本研究成果は、英国科学誌「nature」に、6月5日(木)0時(日本時間)に公開されました。
なお、本研究は、日本学術振興会科学研究費補助金、同補助金の学術変革領域研究A「細胞運命コード」(領域代表:立花誠)の一環として行われ、クイーンズランド大学のピーター・クープマン教授との国際共同研究により行われました。
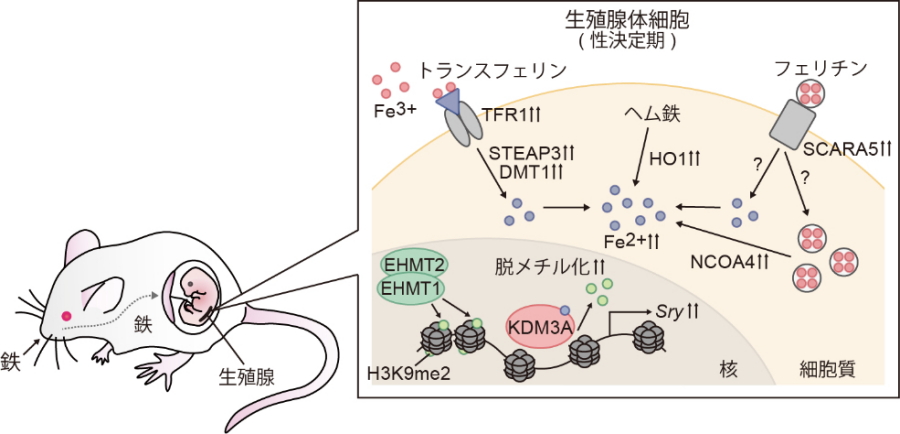
図1.
これまでに分かっていたこと
- Sryはマウス性決定期に一過的に発現し、精巣形成を開始する鍵遺伝子である。
- KDM3AはヒストンH3K9の脱メチル化酵素であり、Sry遺伝子座の構造を変えて転写を活性化する。
- H3K9メチル化酵素であるEHMT1/2複合体は、KDM3Aと拮抗してSry遺伝子座の抑制状態(H3K9me2)を維持する。
- KDM3AをはじめとするJmjCファミリーは、酵素活性にFe2+を必要とする。
今回の研究で新たに明らかになったこと
- 性決定期の生殖腺では、鉄の取り込みやFe2+の産生経路が活性化しており、Fe2+が高濃度に蓄積している。
- 鉄の取り込み阻害(Tfrc欠損)やFe2+除去(Dfo処理)すると、KDM3Aの酵素活性が阻害される。その結果、Sryの発現が低下して精巣形成が阻害される。
- 母体への鉄キレート剤(Dfx)投与や鉄欠乏食給餌によって胎仔の鉄量が低下する。その結果、Sryの発現が抑制され、オスからメスへの性転換が起きる。
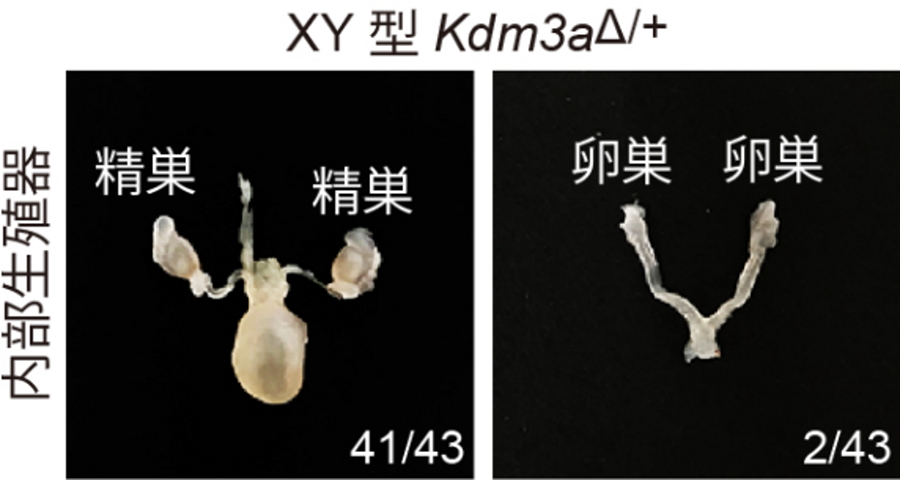
図2.
鉄欠乏餌を与えた母親から産まれたXY型Kdm3aΔ/+マウスの内部生殖器の写真。一部の個体がY染色体を持つにも関わらず卵巣を2つ持っていた。
用語解説
- セルトリ細胞
セルトリ細胞は、精巣内に存在する支持細胞で、精子を形成するための環境を提供する役割を担う。まだ性的に分化していない胎生11.5日のXY生殖腺にはセルトリ細胞は存在しておらず、その前駆体細胞が存在する。この前駆体細胞のことを「プレセルトリ細胞」とよぶ。プレセルトリ細胞でオス化性決定遺伝子Sryが発現すると、その細胞はセルトリ細胞へと分化していく。 - RT-qPCR解析
RT-qPCR(Reverse Transcription quantitative Polymerase Chain Reaction)は、細胞内のmRNA(遺伝子の発現量)を高感度かつ定量的に測定する手法である。まずRNAを酵素でcDNA(相補DNA)に変換し、特定の遺伝子配列をリアルタイムPCRで増幅・定量することで、遺伝子発現の変動を正確に解析することができる。 - scRNA-seq
scRNA-seq(single-cell RNA sequencing)は、個々の細胞ごとの遺伝子発現プロファイルを網羅的に解析する手法である。生体内の組織は多様な細胞種から構成されていますが、scRNA-seqにより各細胞の機能的状態や遺伝子発現の違いを高解像度で可視化することができる。 - ICP-MS解析
ICP-MS(Inductively Coupled Plasma Mass Spectrometry)は、非常に微量な金属元素を高精度に定量する分析技術である。試料を高温プラズマでイオン化し、質量分析計で元素ごとに分離・検出することで、細胞や組織に含まれる鉄などの濃度を正確に測定できる。 - ChIP-qPCR解析
ChIP-qPCR(Chromatin Immunoprecipitation followed by quantitative PCR)は、特定のDNA領域に存在するヒストン修飾や転写因子の結合状態を解析する方法である。まず、細胞内のDNAとタンパク質の複合体(クロマチン)を固定し、目的の修飾(たとえばH3K9me2)に特異的な抗体で免疫沈降する。その後、PCRで特定の遺伝子領域を定量することで、そこにどれだけの修飾が存在していたかを調べることができる。
| 原著論文 | Nature 643(8070):262-270 (2025) |
|---|---|
| 論文タイトル | Maternal iron deficiency causes male-to-female sex reversal in mouse embryos |
| 著者 | Naoki Okashita (1), Ryo Maeda (1), Shunsuke Kuroki (1), Kyona Sasaki (1), Yoko Uno (1), Peter Koopman (2), Makoto Tachibana (1)
|
| PubMed | 40468068 |
