匂いを感じる瞬間のCa2+の振舞いを遂に解明
ナノ生体構造内でのイオンチャネル活動とCa2+応答の同時記録に成功!
| 原著論文 | J. Gen. Physiol. 155(4):e202213165 (2023) |
|---|---|
| 論文タイトル | Segregation of Ca2+ signaling in olfactory signal transduction |
| 研究室サイト | 生理学研究室〈倉橋 隆 教授〉 |
概要
大阪大学大学院生命機能研究科の竹内裕子准教授らの研究グループは、嗅細胞の線毛で匂いを感じる際に必要な信号増幅と慣れ(嗅覚順応)にはCa2+が同時に二役を司り、両者をうまく分離してコントロールしていることを明らかにしました。実験の方法として、ナノサイズレベルの生きた線毛の電気的な興奮を記録しながら、その内部のCa2+の動きを同時に可視化するという新しい実験技術を開発しました。
嗅覚は鼻腔内の嗅上皮にある感覚神経細胞、嗅細胞でシグナルを受け取るところから始まります。匂いは主に低分子の炭素化合物で、各分子の信号が嗅細胞の線毛上で化学情報から生体信号へと変換されます(図1)。この電気信号の発生に直接かかわるのはイオンチャネルと呼ばれる細胞膜にあるたんぱく質で、嗅細胞の場合、線毛内のサイクリックAMP(cAMP、環状AMP)が開くサイクリックヌクレオチド感受性(CNG)チャネルが陽イオンを流します。ここで発生した生体信号が後に脳へと伝えられ、「匂い」として認知されます。その中で、重要な働きをしているCa2+は2つの相反する機能を同時に担っています。1つはCa2+活性化Cl-チャネルを開いて信号を増幅している点。もう1つはカルモジュリン(CAM)というたんぱく質と一緒にCNGチャネルを一旦閉じて順応を起こす点。つまり、Ca2+は線毛の中に入り、信号の増幅と減少という反対の機能を同時に行っているのです。しかも、cAMP分子やCa2+が線毛内ではほとんど横方向に移動しないことがすでに分かっており、1ミクロン以下の微細な区画内でこの2つが起こっていると考えられています。しかし、線毛の直径が100〜200nmという微細構造なので、生きた試料での実験や解析が難しく、その仕組みは謎のままでした。
そこで、今回の研究では、①微小ガラスピペットでイオンチャネル活動を記録し、そのピペットから線毛内に②ケージドcAMPと③Ca2+感受性色素(Fluo-4)を同時に流し込み、それらの物質の局所UV刺激や局所Ca2+測光に、それぞれの目的に合った④レーザー光とレーザー走査型顕微鏡を利用するという4つのテクニックを同時に駆使した実験を行いました(図1)。この方法を使うと、線毛内のCa2+色素に可視光レーザーを当てて線毛内のCa2+濃度を測定しながら、UVレーザーを照射してケージドcAMPから局所なcAMP生成を起こし、その際に開くCNGチャネルとCl-チャネルの電流を計測することができます。つまり、嗅線毛内微小区画の応答と順応を観察しながら、同時に微小区画内のCa2+濃度変化を観察することが出来るのです。実験の結果、微小空間で開くCNGチャネルを通って線毛内に流入したCa2+の濃度増加に伴い局所の蛍光信号が上昇しましたが、その蛍光は信号増幅を担うCa2+活性化Cl-成分を含む電流の減少とともに基底レベルに戻りました。しかし、驚いたことにCa2+依存性の順応は、蛍光強度が基底レベルに戻った後も10秒程度も長く持続することを見出しました。
つまり、順応とはCa2+がCNGチャネルを介して流入した後、ゆっくりとCNGチャネル-カルモジュリン複合体(CNG-CAM)に結合し、その状態がしばらく維持される現象であると解釈できます。その際、Cl-チャネルによる信号増幅は、Ca2+がCNGチャネルに結合するまでの間に行われ、Ca2+がCNG-CAMに占拠されるにつれて電流は減少していき、Ca2+がすべてCAMに結合すると消失することから起こっている現象と考えられます。このように、この複雑な2つの機能が一種類のイオンによって制御されていることを新たな実験方法によって解明するに至りました。
研究の背景
実際の嗅覚のシグナル伝達は、cAMPを介して1秒程度で進行する化学反応によって行われます。Ca2+は細胞外からCNGチャネルの開口によって線毛内へ流入し濃度が上昇しますが、そのCa2+は嗅覚の信号増幅と順応という2つの主要な機能を支えています。信号増幅は、Ca2+で活性化されたCl-チャネルの開口によって起こります。それと同時に、順応は、CNGチャネルへのCa2+フィードバックによって制御されています。このように、Ca2+の流入とそれに伴う細胞質Ca2+レベルの上昇は、チャネル電流を増加させる一方で、順応によってチャネル電流を減少させるという、対立する作用を担っています。この2つの機能は、一見すると互いに打消しあうように解釈されがちです。両者が本当に、実際の線毛で、分離して行われているかを知るためには、線毛の興奮と線毛内のCa2+を直接同時に測定する必要がありましたが、嗅線毛の直径は100〜200nmと非常に細い構造体であるため技術的な困難が伴い、生理学的実験や系統的な解析ができませんでした。そこで、生体から取り出した単一の嗅細胞に微小ガラスピペットを使った電気生理学、レーザー光による局所Ca2+可視化、ケージドcAMPの光解離を駆使して、生きている嗅線毛内一区画でのcAMPジャンプに対するチャネル活動とCa2+濃度をミリ秒分解能でリアルタイム同時測定、解析することに成功し、課題を解決することができました。
本研究の成果
本研究は、生きたままの嗅線毛のサブミクロン空間において、Ca2+による信号増幅と順応によるシグナル減少という相反する2つの機能が明確に棲み分けされていることを新規の手法を導入することで解明しました。これによって、普段私達が日常生活で利用する嗅覚の知覚や順応のしくみを分子の動きで説明することが可能になります。順応に関してはCa2+はCNGチャネルを介して流入した後、ゆっくりとCNGチャネル-カルモジュリン複合体(CNG-CAM)に結合し、暫く結合したままになっていることが実験結果から明らかになりました。それと同時に、Clチャネルによる信号増幅は、Ca2+がCNG-CAMに結合するまでの間に行われ、Ca2+がCAMに結合するにつれて減少していき、Ca2+がすべてCAMに結合すると消失するという現象が観察されました。
研究成果のポイント
- 私達が匂いを感じる嗅覚は、鼻の中のセンサー細胞に生える嗅線毛が分子をキャッチすることから始まる。その時、Ca2+が線毛に入って信号増幅と慣れ(嗅覚順応)によるシグナル減少という2つの重要な働きを持つ。しかし、同一のイオンが同時に増幅と減少という対立する効果をどのように行うかが長年の謎とされてきた。今回、生きたままの線毛のサブミクロン微小区画のイオンチャネル活動とCa2+動向を同時に記録する実験に成功し、この問題の解明に至った。
- 検証が困難だった理由として、直径100nm(コロナウイルスの直径と同じ程度)という微細構造体である線毛において、生きて活動している状態のまま内部の物質を可視化し、同時にチャネル活性を測定する実験技術が確立できていなかったことがあげられる。今回、14年に及ぶ試行錯誤の末に、4種類のテクニックを同時に駆使するシステムを新構築することで、実験と解析が可能となった。
- ナノサイズレベルの生体構造内での分子の挙動を研究する方法を確立し、これまで研究が難しいとされる同様の微細構造における生体機能を探る最先端の研究に利用できる可能性が拓けた。また、私達の日常生活で嗅覚にまつわる環境改善や、ヒト型嗅覚センサー開発などの幅広い応用が期待される。
本研究成果が社会に与える影響(本研究成果の意義)
本研究で、線毛内Ca2+の動向が明らかとなったことで、これまで謎だった嗅覚の「興奮」と「慣れ」の分子制御システムの理解が大きく前進しました。嗅覚は日常的な感覚で、普段は「あって当然」と思われがちな感覚ですが、匂いを感じるしくみが分かり始めたことで、良い香りを増幅するとか好まれない匂いを抑えるとか、私達が生活の中の嗅覚を調節するという応用の可能性が大きく広がったと考えられます。将来的には、信号増幅や順応も取り入れたヒト型嗅覚センサーの開発なども期待されます。また、広い範囲での生体研究の歴史を見ても、このような実験は皆無で、ナノサイズレベルの生体構造の研究におけるさきがけ的な位置づけであり、今後、本方法や実験アプローチが、未知の領域の生体内、微細構造体内での研究に応用できるものと期待されます。
研究者のコメント
この研究は、これまで見ることができなかったものが見え、測ることができなかったものが測れたことで、ようやく私達が日常的に感じている嗅覚のしくみの謎の1つが解き明かされたものです。非常に小さな場所からの微弱な信号ですから、検出するためには数多くの工夫が必要でした。市販品の実験機器では対応できない部分は自作の機械を作って実験セットに組み込むというちょっとした技術も盛り込んでいます。実験操作自体も容易ではなく、記録を行う細胞が正常でいられる10分程度の間に、微小な光を捉えるためにレーザーの走査速度や回数・範囲・光強度を細かく設定しながら、いくつかのテクニックも同時進行するため、多くの制御装置を手際よく操作する必要があります。また、光感受性物質を利用しますので、暗い部屋ですべての操作を行わなければなりません。そのため、細胞の状態変化は音に変換して音として細胞の生死をモニタしながら記録を取ることも必須でした。最初のテストデータの記録から、システムに改良を加えたり、何度も実験を繰り返したりと、論文になって世にでるまで14年の歳月を要しました。1つのことをじっくりと間違いのないように何度も注意深く確認しながら、粘り強く諦めないで研究をする姿勢も大切だということを痛感いたしました。(竹内裕子)
特記事項
本研究成果は、米国科学誌「Journal of General Physiology」に、2023年2月14日にオンライン公開されました。
本研究はJSPS科研費JP25460288、JP26115710、JP16K08495(HT)、JP26430016(TK)の助成を受けたものです。
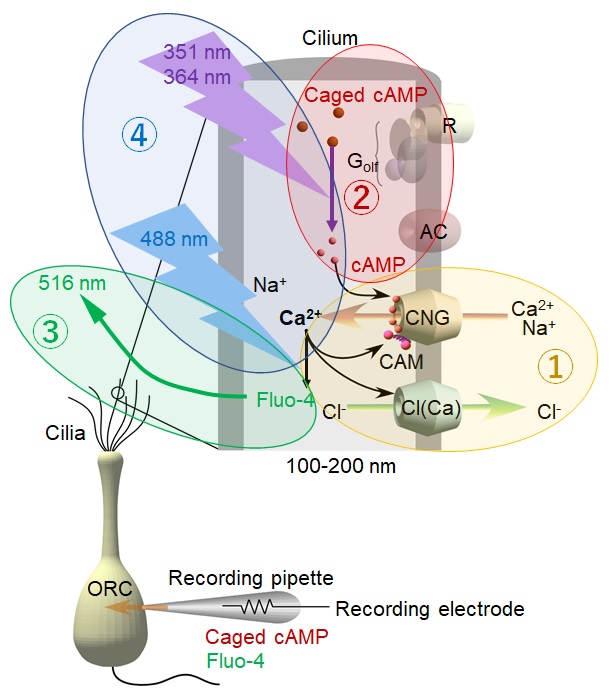
図1.
実験方法模式図。 ①②③④を同時併用することで、生きた線毛の応答と内部の分子の働きを同時に記録、解析可能とした。
用語解説
- 信号増幅
匂いの信号増幅。空気中を漂う匂い分子は非常に微弱な信号しか持たないので、嗅線毛内でいくつかの信号増幅機構が存在する。生体信号を発生するためのイオンチャネルが開口するステップでは、CNGチャネル開口で生じた第一の電流が、そこを通って流入したCa2+で活性化されるCl-チャネル電流によって非線形に(通常は濃度が2倍になると応答も2倍であるが、注視すべき濃度範囲では、濃度が2倍になると応答が10倍にも)増幅されるのが特徴。 - 慣れ(嗅覚順応)
匂いへの慣れ・順応。応答の濃度範囲(ダイナミックレンジ)を広くする機能を指す。つまり、この機構によって嗅細胞は薄い匂いから非常に濃い濃度まで受容して濃度の違いを脳へ知らせることができる。現象としては、同じ匂いをずっと嗅ぎ続けると、匂いを感じなくなったり、1度匂いを嗅いだ直後(数秒)に同じ匂いを嗅ぐと弱まって感じたりすることとして現れる。これは匂いを感じなくなったのではなく、次に来るであろう強い匂いを感じるために匂いの環境に慣れているのである。嗅線毛では順応からの回復までに10秒程度かかる。この現象もCNGチャネルを通って線毛内に流入したCa2+が制御している。 - サイクリックAMP(cAMP、環状AMP)
生体エネルギーの通貨とも呼ばれるアデノシン三リン酸(ATP)から誘導される重要な分子。アデノシンのリボースの3位、5位とリン酸が環状になった構造をとる環状ヌクレオチドの一種で、細胞外リガンドに応じた細胞の多種多様な生理的応答を媒介する代表的な細胞内情報伝達物質(セカンドメッセンジャー)の1つである。嗅細胞線毛の匂い情報変換機構でもセカンドメッセンジャーとして働く。 - サイクリックヌクレオチド感受性(CNG)チャネル
サイクリックヌクレオチドの結合に応答して機能するイオンチャネル。CNGチャネルは、様々な組織や細胞型の膜に見られる非選択的な陽イオンチャネルであり、視覚や嗅覚などの感覚受容や細胞の発達に重要。 - Ca2+活性化Cl-チャネル
細胞内のカルシウムイオンにより開口するCl-チャネル。通常、神経細胞などに発現しているCl-チャネルは抑制性に働くことが多いが、嗅線毛の場合、線毛内のCl-濃度が高く、Cl-が細胞外に流出することから、内向き電流が増幅されることと同じ意味を持つため、信号増幅に貢献する。 - カルモジュリン(CAM)
カルシウム結合タンパク質の1つ。多くの細胞に存在し、カルシウムバッファーとして機能する。嗅細胞においては、CNGチャネル付近に存在しており、CNG-CAMを形成している。流入したCa2+イオンと結合し、細胞の内側からCNGチャネルのcAMPアフィニティーを変化させることで、嗅覚順応を引き起こす。 - ケージドcAMP
生理活性を持つcAMPに光分解する特定の側鎖(ケージング基)を付加することで、一時的に生理活性をなくした物質。光照射により、ケージング基が外れ、元の生理活性分子として機能する。 - 嗅線毛(きゅうせんもう)
嗅細胞で匂いを感じる部分。体外環境である粘液層に伸びているので、外界からの匂い分子をキャッチできる。直径100〜200nm、長さ10µm、1細胞あたり10本程度存在している。同様の構造を持つ微細な細胞小器官を繊毛と表記することもあるが、ヒトやそれに準ずる組織の場合には線毛と表記するのが慣習である。
| 原著論文 | J. Gen. Physiol. 155(4):e202213165 (2023) |
|---|---|
| 論文タイトル | Segregation of Ca2+ signaling in olfactory signal transduction |
| 著者 | Hiroko Takeuchi (1), Takashi Kurahashi (1)
|
| PubMed | 36787110 |
