細菌の回転モーターは静電相互作用で滑らかに回る
モーター回転と自己構築機構の新知見が新たなナノデバイスの応用に
| 原著論文 | Nat. Commun. 12:4469 (2021) |
|---|---|
| 論文タイトル | Structure of the molecular bushing of the bacterial flagellar motor |
| 研究室サイト | 日本電子YOKOGUSHI協働研究所〈難波 啓一 特任教授(常勤)〉 |
概要
大阪大学大学院生命機能研究科日本電子YOKOGUSHI協働研究所の大学院生の山口智子さん(学振特別研究員/博士後期課程)、牧野文信招へい准教授(日本電子(株))、宮田知子特任准教授(常勤)、難波啓一特任教授(理化学研究所生命機能科学研究センターチームリーダー兼任)、同研究科プロトニックナノマシン研究グループの南野徹准教授、同大学蛋白質研究所の加藤貴之教授の共同研究グループは、べん毛モーターの軸受けが回転軸との静電相互作用により回転時のエネルギー損失を最小化するメカニズムを明らかにしました。
回転型モーターには、回転子や固定子の他に、トルクを外部に出力するための回転軸と、軸を支える軸受けが存在します。モーターの回転中には軸と軸受けの摩擦に由来するエネルギー散逸が生じるため、軸受けにはボールベアリングや潤滑剤を用いてエネルギーロスを減らす仕組みが施されています。
共同研究グループは、細菌のもつ生体分子モーターが人工モーターとは異なり、静電相互作用によって回転中の軸と軸受けのエネルギー散逸を最小化していることを発見しました。
サルモネラ菌はべん毛と呼ばれる運動器官を持ち、人工の回転モーターと非常によく似たべん毛モーターでらせん型のべん毛繊維をプロペラとして回転させ遊泳します。べん毛は回転モーターとして働く基部体、ユニバーサルジョイントのフック、らせん型プロペラである繊維の、3つの部分構造で構成されており、30種類ほどのタンパク質が段階的に組みあがることで自己構築されます(図1)。基部体の一部として存在するLPリングとロッドはそれぞれ軸受けおよび軸として機能し、LPリングがロッドを取り囲み支えることで安定した回転をサポートします。べん毛モーターは細胞膜内外の膜電位差と水素イオン濃度差によるポテンシャルエネルギーをほぼ100%の効率でトルクに変換し、F1レーシングカーのエンジンに匹敵するほどの高速で回転する非常に効率の良いモーターとして知られています。しかし、軸受けの立体構造が不明であったため、モーターの高いエネルギー変換効率を可能とするメカニズムや、軸周りに軸受け構成タンパク質が自律集合して自己構築する仕組みはわかっていませんでした。
今回、共同研究グループは、軸と軸受けを含む基部体の立体構造をクライオ電子顕微鏡による単粒子構造解析法を用いて解析することで、LPリングの分子構造を3.5Åの分解能で解析しました(図2)。この構造情報から、1)特徴的な長いβストランドによって網籠状に裏打ちされた3層のバレル構造がLリングの構造を頑丈にしていること、2)LPリングが軸との間の静電引力と静電反発力をバランス良くもちいて摩擦によるエネルギー散逸を最小化していることを発見しました。さらに遺伝解析的手法をもちいることで、3)Pリング内側表面の正電荷が負に帯電したロッド表面に効率的に集合することを可能にすることを発見しました(図3)。
本研究成果は、軸-軸受け静電相互作用が、モーターの回転だけでなく軸受けの自己構築機能においても関与していることを世界で初めて明らかにしたものです。これらの発見は、自己構築可能でエネルギー変換効率の高いナノデバイスへの応用へとつながり、将来的には工学的応用やドラッグデリバリーシステムなどへの活用が期待されます。
研究の背景
サルモネラ菌は、べん毛モーターと呼ばれる回転モーターを用いて遊泳します。回転軸であるロッドは、細胞内で生じたモーターのトルクを細胞外の繊維やフックに伝えます。軸受けであるLPリングは外膜(Lリング)とペプチドグリカン層(Pリング)にまたがって存在し、ロッドを取り囲んでその高速回転を支えています。モーターの高いエネルギー変換効率から、回転時におけるロッドとLPリングの摩擦によるエネルギー損失が最小限に抑えられていることが示唆されていました。ロッドの構造は既にクライオ電子顕微鏡の単粒子構造解析やX線結晶構造解析で明らかにされており、表面が主に負に帯電していることも知られていましたが、LPリングは巨大な膜タンパク質複合体であるため大量精製が難しく、結晶化も困難で、立体構造が不明なままでした。また、LPリングを構成するFlgHとFlgIタンパク質は、他のべん毛構成要素とは異なる経路からペリプラズム領域へ分泌されており、これらがどのようにロッドの周りへ自己集合するのかも不明でした。
本研究の成果
共同研究グループは、軸と軸受けの相互作用を詳細に調べるため、両者を含む基部体複合体の立体構造をクライオ電子顕微鏡による単粒子構造解析法で解析しました。さらに、LPリングを集中的に解析することで、アミノ酸主鎖側鎖構造の見える3.5Åの分解能で分子構造を明らかにしました。その結果、1)FgHの長いβストランドによって裏打ちされた3層のバレル構造がLリングの構造安定性に寄与していること、2)LPリングの内側表面が正と負の両方に帯電しており、LPリングとロッドは静電引力と静電反発力をバランス良く用いてエネルギー散逸を最小化させていることを発見しました(図3a)。さらに、異種間でも高く保存され、かつ正に帯電したFlgIのアミノ酸残基を中性または負電荷を持つアミノ酸に変異させることで、3)Pリング内側表面の正電荷が、負に帯電したロッド周りへの効率的な自己集合に寄与していることを発見しました(図3b)。本研究は長い間謎であった軸受け分子複合体の立体構造を解明し、べん毛モーターがエネルギー散逸を最小化するメカニズムを明らかにするとともに、静電引力により軸受けタンパク質FlgIが軸周りに自己集合し軸受けリングが自己構築される仕組みを発見しました。今後は本研究成果をもとに、回転時の軸-軸受け相互作用や動態をシミュレーション等によって明らかにするとともに、軸受けの自己構築過程における軸との相互作用部位の特定など、さらに詳細な研究発展が期待されます。
研究成果のポイント
- 細菌べん毛モーターが回転時にエネルギー散逸を最小化する仕組みを発見
- 細菌べん毛基部体においてモーターの回転を支える軸受けとして機能するLPリングの立体構造と、その構成要素であるFlgH、FlgIタンパク質の分子モデルを解明
- 回転軸受けと軸が静電相互作用を用いて回転時のエネルギー散逸を最小限に抑えている
- 軸受けが軸周りに自己構築(自律的構造形成)する際にも静電引力相互作用が重要であることを発見
- 上記の発見と解明により自律的構造形成が可能な高エネルギー変換ナノデバイスへの応用に期待
本研究成果が社会に与える影響(本研究成果の意義)
エネルギーが変換される際には、その一部が熱・音・光に変換されエネルギーの損失を伴います。エネルギーロスを抑える技術は限りある資源を有効に活用するために必要不可欠です。細菌のべん毛モーターは室温における分子の熱揺らぎ程度のエネルギーで回転可能で、ほぼエネルギーロスなく高速回転できることを示しています。このことはべん毛モーターが直径数10ナノメートルというナノサイズであることにも大きく起因しており、ここで得られた知見を応用することでエネルギー変換効率の高いナノデバイスへの応用が期待できます。将来的には薬をターゲット部位まで「泳がせて」直接届けるドラッグデリバリーシステムへも活用できる可能性があります。また、細菌のべん毛による遊泳機能は病原菌の感染能力とも深く結びついており、べん毛モーターの回転または形成を阻害することで感染を抑えることが可能です。たとえば軸受けの構築を阻害すると機能するべん毛が形成されないため、ロッド周りのLPリング形成を抑制することで感染症を抑えることができます。また、巨大な膜タンパク質複合体であるため大量精製が難しく結晶化も困難で立体構造解析ができなかったLPリングの構造が解析可能になったのは、クライオ電子顕微鏡の進歩により高速自動撮影ができるようになったからで、クライオ電子顕微鏡法の創薬応用に向けた高いポテンシャルを示しています。したがって、本研究成果はナノ工学や医療創薬の発展に大きく貢献すると期待されます。
特記事項
本研究成果は国際学術誌「Nature Communications」のオンライン版に、7月22日(木)20時(日本時間)に公開されました。
なお本研究は、日本学術振興会科学研究費補助金JP25000013(難波啓一)、JP18K06155(宮田知子)、JP26293097、JP19H03182(南野徹)、文部科学省科学研究費補助金JP15H01640、JP20H05532(南野徹)、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)課題番号JP19am0101117、および医療研究開発革新基盤創成事業(CiCLE)課題番号JP17pc010102(研究代表者:難波啓一)の助成を受けたものです。また理化学研究所から、山口智子は大学院生リサーチ・アソシエイト(JRA)として、難波啓一は生命機能科学研究センターチームリーダーとして支援を受けました。
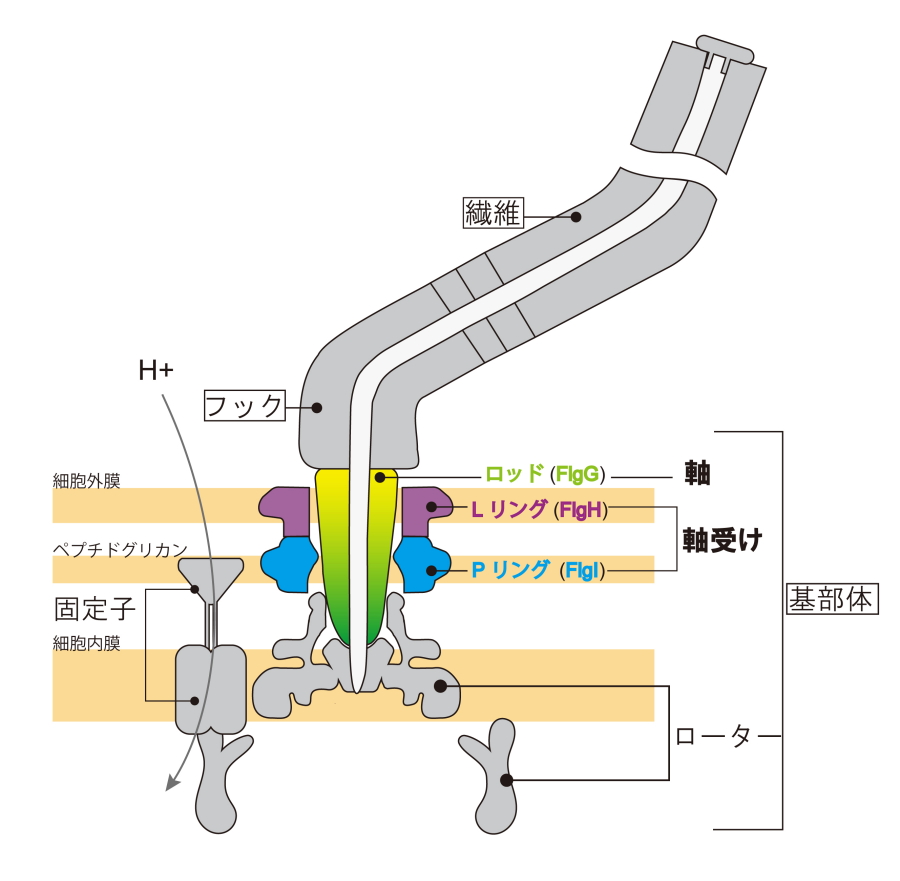
図1.細菌べん毛の構造模式図
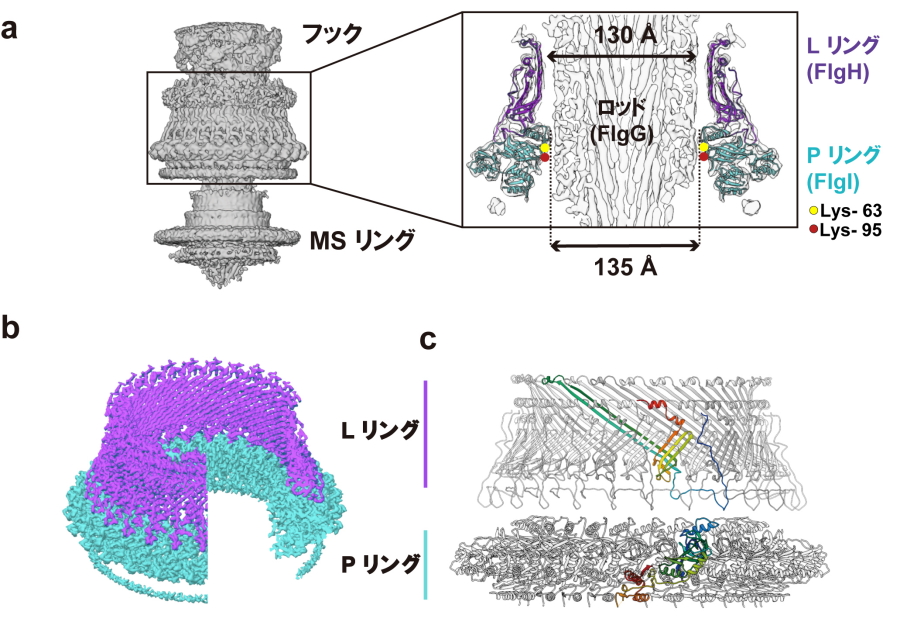
図2.べん毛軸受けの立体構造
a)フック、MSリング、LPリング、ロッドを含む基部体のクライオ電子顕微鏡マップ。右にロッドとLPリング断面拡大図を示す。Lys-63とLys-95はPリング内側表面の正電荷アミノ酸残基。b)LPリングのクライオ電子顕微鏡マップ。c)LPリングの分子モデル。FlgH、FlgI一分子をそれぞれレインボーで示す。
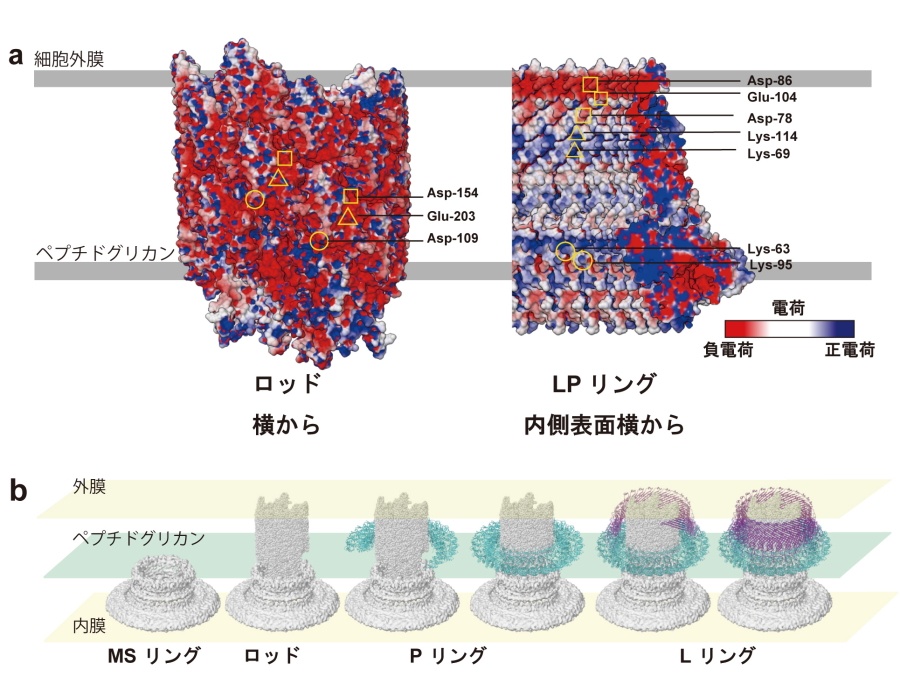
図3.ロッドとLPリング表面電荷と構築過程のモデル
a)ロッド表面とLPリング内側表面の電荷。正電荷を青、負電荷を赤で示す。特徴的な電荷をもつアミノ酸を黄色枠で示す。b)ロッド周りにLPリングが構築される過程のモデル。構築順序は左から右。
用語解説
- 静電相互作用
電荷をもつ物質同士により引き起こされる相互作用。正電荷と負電荷ならば静電引力、正電荷または負電荷同士ならば反発力が働く。タンパク質同士の場合、帯電性の側鎖を持つアミノ酸により生じる。 - 自己構築
生体分子が自発的自立的に集合して複雑な複合体構造を形成し、個々の構成分子にはない高次の機能を持つようになること。 - トルク
物を回転させることができる力のこと。単位はNm。例えば100Nmのトルクを発生するエンジンの場合、エンジンの動力軸に1mの棒を取り付けたとき、棒の先端で100Nの力を発揮する。 - ボールベアリング
人工の回転モーターの軸受け(ベアリング)の一種。回転部との接地面に球(ボール)を敷き詰めることで軸との摩擦力を軽減する。 - クライオ電子顕微鏡による単粒子構造解析法
タンパク質の立体構造解析手法の一つ。極低温で急速凍結し非晶質の氷薄膜に包埋したタンパク質など生体分子の投影像を電子顕微鏡で多数撮影し、様々な方向からの投影像を収集して平均化により各投影像の画質を上げ、最終的に2次元象を3次元空間に逆投影することで立体構造を再構成する。 - βストランド
タンパク質の2次構造のひとつ。主鎖が伸びた構造でシート状の構造をとる。 - ドラッグデリバリーシステム
医薬の必要最小限の量を、必要な時間に必要な場所に的確に届けるための手法。注射や服用の回数を減らすほか、副作用を抑えるために研究が進められている。 - ペプチドグリカン層
細菌の細胞壁で、ペプチドと糖から構成された高分子化合物の層。サルモネラ菌などのグラム陰性菌では細胞膜と細胞外膜の間に存在する。グラム陽性菌は細胞外膜の代わりに分厚いペプチドグリカン層を持つ。 - X線結晶構造解析
分子の立体構造解析法の一つ。タンパク質ではその結晶にX線を照射し、その回折パターンから原子の立体配置を特定する。 - ペリプラズム
細菌の細胞体内で細胞膜とペプチドグリカンに挟まれた領域のこと。
| 原著論文 | Nat. Commun. 12:4469 (2021) |
|---|---|
| 論文タイトル | Structure of the molecular bushing of the bacterial flagellar motor |
| 著者 | Tomoko Yamaguchi (1, 2), Fumiaki Makino (1, 3), Tomoko Miyata (1), Tohru Minamino (1), Takayuki Kato (1, 4), Keiichi Namba (1, 2, 5, 6)
|
| PubMed | 34294704 |
