真核細胞の運動方向を決める分子基盤となる脂質-タンパク質相互作用を解明
| 原著論文 | Commun. Biol. 3(1):92 (2020) |
|---|---|
| 論文タイトル | Single-molecule imaging of PI(4,5)P2 and PTEN in vitro reveals a positive feedback mechanism for PTEN membrane binding |
| 研究室サイト | 1分子生物学研究室〈上田 昌宏 教授〉 |
概要
大阪大学大学院生命機能研究科の上田昌宏教授(理化学研究所生命機能科学研究センターのチームリーダーを兼任)の研究グループは、PTENの反応産物であるPI(4,5)P2がPTENの膜結合を安定化するという正のフィードバックを解明しました。
細胞が方向性をもって運動するためには、細胞の前後が決まっている必要があります。イノシトールリン脂質は細胞膜上で前後の情報を伝達するシグナル分子として知られ、PI(3,4,5)P3が前側に、PI(4,5)P2が後ろ側に局在しています。これにはPI(3,4,5)P3をPI(4,5)P2に脱リン酸化する酵素PTENが細胞の後ろ側の細胞膜に蓄積することが重要だと知られていました。しかし、その詳しいメカニズムはよくわかっていませんでした。
今回、研究グループは、人工脂質膜に結合したPTENを1分子イメージングできる新たな計測法を開発し、PTENとPI(4,5)P2の間に働く相互作用を解析しました。結果、PTENが触媒する酵素反応産物であるPI(4,5)P2がPTENの膜結合を安定化するという正のフィードバック機構が働くことを明らかにしました。さらに、この正のフィードバックが細胞の前後極性を安定化し、直進性の高い効率的な細胞運動をもたらすことがわかりました。
研究の背景
免疫系の細胞のように自ら運動する細胞には前側と後ろ側があり、運動性の高くないニューロンにも情報の送り手側と受け手側という方向性があります。こうした一つの細胞内でみられる方向性は細胞極性と呼ばれ、方向を決定するシグナル分子が細胞内で非対称的な局在を示すことが様々な細胞でわかってきました。中でも、真核細胞のアメーバ運動のモデル生物である細胞性粘菌は、こうしたシグナル分子の同定に役立ってきました。その代表例がイノシトールリン脂質です。
運動している細胞では、前側の細胞膜上でPI(3,4,5)P3レベルが上昇しており、その結果仮足形成にはたらくシグナル伝達系が活性化されます。一方、それ以外の細胞膜上ではPI(4,5)P2レベルが高く、PI(3,4,5)P3レベルが低く維持されています。これは、細胞の側面や後ろ側で仮足形成が起こるのを防ぐために重要であり、PI(3,4,5)P3を脱リン酸化してPI(4,5)P2に変える酵素であるPTENが不可欠な役割を担っています。実際に、PTENをノックアウトした細胞は仮足形成が細胞膜のあらゆる場所で起こるため、方向性をもった細胞運動ができないことが知られています。
PTENは後ろ側の細胞膜に局在しており、PI(4,5)P2と共局在を示します。過去の研究において、PTENは細胞質と細胞膜を行き来しており、細胞膜への結合にはN末端にあるPI(4,5)P2結合モチーフが重要であることが示唆されていました。しかし、細胞膜のPI(4,5)P2レベルを人為的に変化させることが困難であるため、PI(4,5)P2レベルに依存してPTENの膜結合がどのように変化するのかはわかっていませんでした。
本研究の成果
今回、研究グループは、任意の組成の人工脂質膜を作成し、そこへ蛍光標識したPTENを添加して、膜結合・解離や膜上での側方拡散を1分子イメージングによって定量計測する手法を確立しました(図1)。これにより、PI(4,5)P2レベルに依存したPTENの膜結合時間や2次元拡散係数の変化を解析することに成功しました。
膜のPI(4,5)P2レベルを上げていくと、これに比例してPTENの膜結合時間が長くなり、拡散係数が小さくなることが明らかになりました(図2)。PTENと相互作用するPI(4,5)P2の分子数に依存してPTENの膜結合が安定化することが示唆されます。実際に、PI(4,5)P2結合への関与が想定されるアミノ酸を置換した変異型PTENでは、この安定化が減弱していました。したがって、PTENが膜上でPI(3,4,5)P3の脱リン酸化反応を触媒すると、反応産物であるPI(4,5)P2がPTENの膜結合を安定化するため、PTENの膜結合量が増加するという正のフィードバックが働くと考えられます(図3)。
次に、PI(4,5)P2を介した膜結合安定化が細胞内でも起こっていることを確かめるために、生きた粘菌細胞にこれらのPTENを発現させて1分子イメージングを行いました。変異型PTENは野生型PTENに比べて細胞膜結合時間が短く、拡散係数が大きくなっていたことから、細胞膜でも同じ安定化メカニズムが働いていることが強く示唆されます。
さらに、PI(4,5)P2を介した正のフィードバックの生理的意義を調べるために、粘菌細胞のもつPTENをノックアウトして変異型PTENを発現させることで、フィードバック強度を生細胞内で実験的に操作することを試みました。その結果、変異型PTENに交換した細胞では細胞膜上でPI(3,4,5)P3が局在する領域が拡大し、細胞運動の直進性が低下することが明らかになりました(図4)。
以上の結果は、PI(4,5)P2を介した正のフィードバックがPTENを膜に蓄積させることで、細胞の前後極性を安定化し、細胞運動の指向性を強化するというモデルを示唆しています。
研究成果のポイント
- <成果>PTENの酵素反応産物であるPI(4,5)P2がPTENの膜結合を安定化する正のポジティブフィードバックを明らかにした。
- <背景>PTENが反応産物であるPI(4,5)P2とともに細胞膜に蓄積して細胞の後ろ側(仮足形成を抑制する側)を決定する機構はよくわかっていなかった。
- <今後の展望>本研究で開発した計測手法はタンパク質と脂質膜の相互作用を定量的に解析するための汎用性の高い新たなプラットフォームとなる。細胞内では解析が難しいフィードバックの分子メカニズムの解明に資すると期待される。
本研究成果が社会に与える影響(本研究成果の意義)
これまでにも細胞の極性形成に正のフィードバックが関与することは示唆されていましたが、本研究では精製したタンパク質と人工脂質を用いてフィードバックの最少構成単位となる分子間相互作用を定量的に明らかにすることに成功しました。また、これまでの1分子イメージング研究はin vitro系あるいは細胞系の専らどちらかで行われることが多かったのに対し、本研究では2つの系で並行して解析しました。これにより、PI(4,5)P2による膜結合の安定化は、人工膜上でPI(4,5)P2とPTENだけでも起こるPTEN分子に本質的な反応であるとともに、生体膜上でも実際に起こって細胞の動態を制御していることを証明することに成功しました。これらの解析手法は細胞内情報伝達系全般に対して適用可能であり、幅広い現象においてシグナル分子の振る舞いの分子レベルでの理解を可能にすると考えられます。また、PTENの膜結合能の欠損はがん細胞の増殖や浸潤とも深く関係するため、本研究で明らかにしたメカニズムはこれらの制御機構の解明に資すると期待されます。
特記事項
本研究成果は、2020年2月28日(木)19時(日本時間)に英国科学誌「Communications Biology」(オンライン)に掲載されました。なお、本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究C「細胞の前後極性のリポソーム内再構成」(研究代表:松岡里実)(JP25871120)、JST戦略的創造研究推進事業さきがけ(JST-PRESTO)の研究領域「計測技術と高度情報処理の融合によるインテリジェント計測・解析手法の開発と応用」における研究課題「データ同化による1細胞内自己組織化過程の全可視化」(研究代表:松岡里実)(JPMJPR1879)、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」(研究開発総括:横山信治)における研究開発課題「1分子・質量イメージング顕微鏡の開発と細胞膜機能解析」(研究開発代表:上田昌宏)(JP18gm0910001)の一環として行われました。
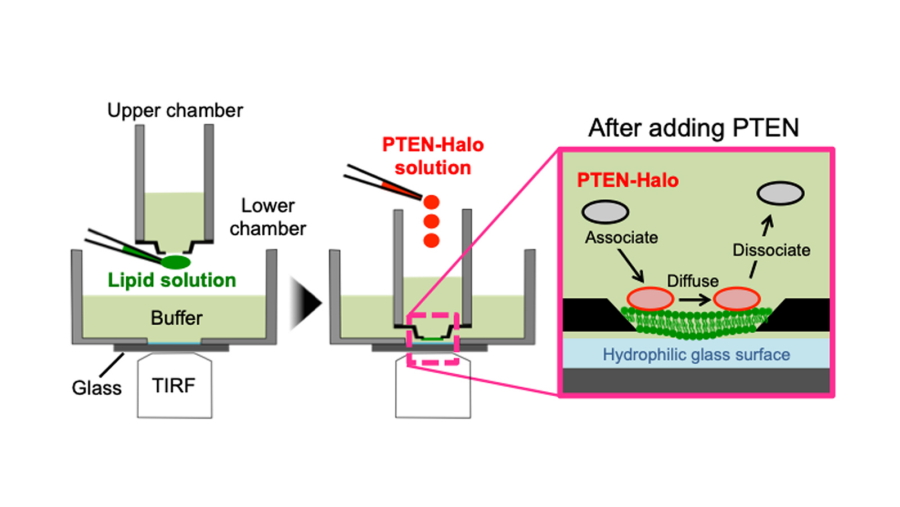
図1.in vitro1分子イメージング実験系の模式図
ガラス基板上に任意の脂質組成の人工脂質膜を作成したあと、上側チャンバーに蛍光標識したPTENの懸濁液を滴下した。全反射照明を用いて膜に結合したPTENを1分子レベルでイメージングした。
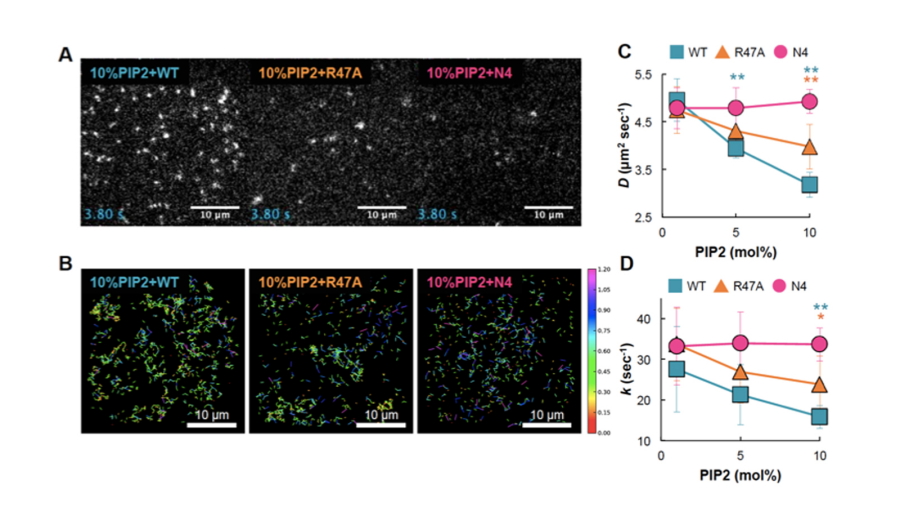
図2.PTENの膜結合動態のPI(4,5)P2濃度依存性
(A)10% PI(4,5)P2を含む人工脂質膜に結合したPTENの1分子イメージング画像。WT(青)は野生型PTENを示す。PI(4,5)P2と相互作用すると考えられる塩基性アミノ酸残基を1個(R47A、オレンジ)または4個(N4、マゼンタ)アラニンに置換した変異型PTENについても同様に解析した。(B)図2AのPTEN分子の拡散軌跡。カラーバーは16.5msecあたりの分子の移動距離(µm)を示す。(C)各組み換えPTENの拡散係数のPI(4,5)P2濃度依存性。(D)各組み換えPTENの膜からの解離速度定数のPI(4,5)P2濃度依存性。

図3.PI(4,5)P2によるPTENの膜結合動態制御メカニズムの概略図
PI(4,5)P2レベルが高いと、PTEN分子は複数のPI(4,5)P2分子と相互作用するため、結合時間が長くなり、拡散が遅くなる。一方、PI(4,5)P2レベルが低いと、相互作用するPI(4,5)P2分子数が少ないため、結合時間が短く、拡散が速くなる。細胞内ではそれぞれ後ろ側と前側の膜環境に相当し、後ろ側で正のフィードバックがはたらいてPTENが細胞膜に蓄積すると考えられる。
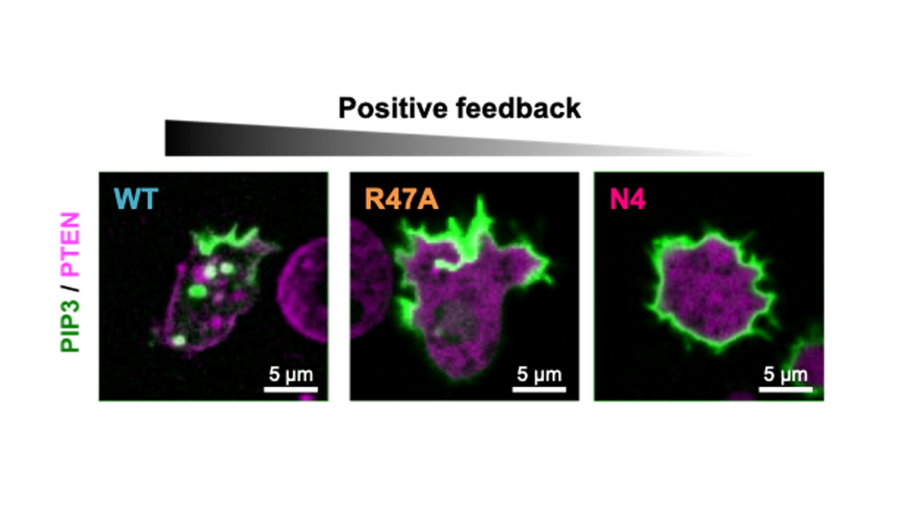
図4.正のフィードバックが細胞極性に及ぼす影響
PTEN(WT、R47A、N4)をPTEN欠失細胞に発現させ、PI(3,4,5)P3(緑)とPTEN(マゼンタ)の局在を観察した。PI(4,5)P2を介した正のフィードバックが弱まると、膜上のPI(3,4,5)P3局在領域が拡大した。これに伴って仮足形成が起こる領域も拡大し、細胞極性が失われた。
用語解説
- PTEN
がん抑制因子として同定された脱リン酸化酵素。シグナル分子として機能するイノシトールリン脂質の3位リン酸基を脱リン酸化することで、これらの下流のシグナル伝達系の活性を調節する。 - 正のフィードバック
ある因子が活性化したとき、最終的にその因子のさらなる活性化を引き起こす分子間ネットワークループ。例えば、ある2種類の因子AとBの間で互いに活性化(もしくは抑制)しあう相互作用が存在する時、AとBは正のフィードバックループを形成する。 - 1分子イメージング
分子を1分子レベルで可視化するイメージング技術。本研究で用いた全反射照明蛍光顕微鏡法では、ガラスと水の境界面でレーザー光を全反射させた時に生じる近接場光を用いることで、膜近傍の蛍光分子のみを励起し背景光を軽減することが可能である。 - 細胞極性
細胞が示す機能的・形態的な非対称性。細胞内で分子が空間的に偏って局在または機能することにより生じる。
| 原著論文 | Commun. Biol. 3(1):92 (2020) |
|---|---|
| 論文タイトル | Single-molecule imaging of PI(4,5)P2 and PTEN in vitro reveals a positive feedback mechanism for PTEN membrane binding |
| 著者 | Yoshioka D (1, 2, 3), Fukushima S (1, 2, 3), Koteishi H (2), Okuno D (2), Ide T (4), Matsuoka S (1, 2, 3), Ueda M (1, 2, 3)
|
| PubMed | 32111929 |
