細胞集団運動を制御する細胞間情報伝達の様式が発生段階によって切り替わることを解明
| 原著論文 | Commun Biol (2019) |
|---|---|
| 論文タイトル | Collective Cell Migration of Dictyostelium Without cAMP Oscillations at Multicellular Stages |
| 研究室サイト | 1分子生物学研究室〈上田 昌宏 教授〉 |
概要
大阪大学大学院生命機能研究科の上田昌宏教授(理化学研究所生命機能科学研究センターのチームリーダーを兼任)と九州工業大学大学院情報工学研究院の森本雄祐助教の共同研究グループは、細胞の集団運動を制御する細胞間情報伝達の動態が、発生の進行に伴って大きく変化する現象を世界で初めて発見しました。
細胞集団運動は発生時の器官形成など多細胞生物において重要な役割を担う現象として知られています。その制御には細胞間情報伝達が大きく寄与するものと考えられてきました。しかし、発生現象を通じてどのように細胞間情報伝達が集団運動の制御に関わるのか、その詳しい実態はよくわかっていませんでした。
今回、研究グループは、蛍光顕微鏡イメージング技術を用いることで発生研究のモデル生物である細胞性粘菌の集団運動時の細胞間情報伝達の高感度な可視化に成功し、発生初期に周期的に行われる細胞間情報伝達が発生後期になると定常状態へと遷移することを明らかにしました。今回の発見は、細胞の集団運動の仕組みに関する普遍モデルに新たな視点を与えると共に、がんの浸潤や創傷治癒の仕組みの理解といった医科学分野への貢献も期待されます。
研究の背景
細胞の集団運動は胚発生における器官の形成や傷ついた上皮の治癒など様々な場面で重要な役割を担う現象として知られています。その制御には細胞間情報伝達が大きく寄与するものと考えられていますが、詳しいことは明らかではありません。この細胞集団運動の仕組みを調べるために、細胞性粘菌が古くから用いられてきました。
細胞性粘菌は普段は単細胞性のアメーバですが、餌がなくなり飢餓状態になると細胞が協調的に集合し、細胞塊を形成した後に組織的な運動を行う多細胞体へと移行する発生を行う性質があります(図1)。飢餓状態の粘菌細胞はcAMPというシグナル物質に走化性を示しますが、cAMPを受容した細胞は自らもcAMPを合成し細胞外に分泌します。分泌されたcAMPは近くの別の細胞に受容され、その細胞の走化性とcAMPの合成・分泌反応を引き起こします。このようにして次々と細胞間でcAMPシグナルがリレーのように伝播していき、それと同時に複数の細胞がシグナル伝播の中心に向けて協調的に移動する現象が起きます。これをcAMPリレーと言います。
cAMPリレーは、集合時の細胞運動だけでなく、集合後形成される多細胞体においても組織的な運動を制御していると考えられてきました(図1)。しかし、過去の研究において細胞の集合期にcAMPリレーが周期的に伝播することは確かめられていましたが、集合期以降の多細胞体形成までにおいてcAMPリレーを直接調べた例は無く、発生を通じてどのようにcAMPリレーが集団運動に関わっているかはわかっていませんでした。
本研究の成果
今回、研究グループはcAMPリレーを受け取った細胞内のcAMP濃度変化を高感度な蛍光プローブを用いて検出することで、細胞の集団内でcAMPシグナルが伝播する様子を顕微鏡下で観察する手法を確立しました。これにより集合時には細胞間でcAMPリレーが周期的にらせんパターンを描きながら伝播し(図2)、それに伴い細胞が協調的に運動する様子を可視化することに成功しました。
細胞の集合から多細胞体形成までの発生を通じてcAMPシグナルを顕微鏡下で観察すると、細胞が集合し細胞塊を形成するまでは周期的なcAMPリレー伝播が起きていることが確かめられました。このcAMPリレーは細胞塊内でもしばらく続いていましたが、多細胞体へと移行するにつれてシグナルの振動は弱まっていき、多細胞運動を行う段階になるとcAMPリレーの伝播や振動が消失するということを初めて明らかにしました(図2)。
さらに、cAMPリレーが多細胞体の運動に必要か否かを確かめるため、cAMP合成酵素欠損株の発生過程を調べました。この変異株はcAMPリレーが行えず通常は発生できませんが、特定の条件に置くと集合し多細胞体を形成できます。この発生時のcAMPシグナルを調べると、細胞間でのcAMPリレーを行わずに多細胞運動が起きることがわかりました。このことはcAMPリレーが多細胞体の運動制御に必須ではないことを強く示唆します。
また、今回の研究では発生に異常が見られる変異株を用いてcAMPリレー様式の変化と発生の関係について探りました。この変異株は細胞が集合し細胞塊を形成した段階で発生が止まってしまい、多細胞体へと移行できません。この変異株を用いてcAMPリレーの様式を調べたところ、集合から細胞塊の形成後もcAMPリレーが伝播しつづけ、通常の発生時に見られるようなcAMPリレーの消失が起きないことがわかりました。これはcAMPリレーの消失が多細胞体形成に伴って起きる現象であることを示しています。
以上の結果は、細胞性粘菌の発生を通じて集団運動の制御に重要と考えられていたcAMPリレーが、実は発生段階によって様式が変化していき、多細胞体形成後はシグナル振動が消失して必須ではなくなるという新たなモデルを示唆しています。
研究成果のポイント
- <成果>細胞性粘菌の発生段階を通じて細胞集団運動を制御すると考えられていた周期的な細胞間シグナル伝達(cAMP伝搬波)が、実は発生後期になると消失することを発見。
- <背景>これまで細胞性粘菌の発生を通じた細胞間情報伝達シグナルの実体は計測されていなかった。
- <今後の展望>細胞の集団運動は、様々な生物の発生や傷ついた組織の治癒、がんの浸潤などで見られる重要な生命現象である。今回の成果はそれらの仕組みを理解するための新たな視点をもたらす。
本研究成果が社会に与える影響(本研究成果の意義)
これまで細胞の集団運動は上皮細胞の創傷治癒などの特定の場面のみを対象に研究され、今回の集合から多細胞運動までといった移り変わる生命現象の場面を通じた集団運動の制御機構についてはあまり考察されていませんでした。本研究で発見した発生段階ごとの細胞間情報伝達の様式の変化は、同一生物内でも集団運動の場面ごとにそれを制御する機構が切り替わるという、集団運動の研究において新しい視点をもたらしました。細胞の集団運動は発生やがんの浸潤などにも大きく関わるため、それらの制御機構についても新たな理解につながることが今後期待されます。
特記事項
本研究成果は、2019年1月24日(木)19時(日本時間)に英国科学誌「Communications Biology」(オンライン)に掲載されました。なお、本研究は、日本学術振興会(JSPS)科学研究費助成事業の科学研究費補助金 若手研究(A)(15H05593)、挑戦的萌芽研究(15K14498)、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」(研究開発総括:横山信治)における研究開発課題「1分子・質量イメージング顕微鏡の開発と細胞膜機能解析」(研究開発代表:上田昌宏)(JP18gm0910001)の一環として行われました。
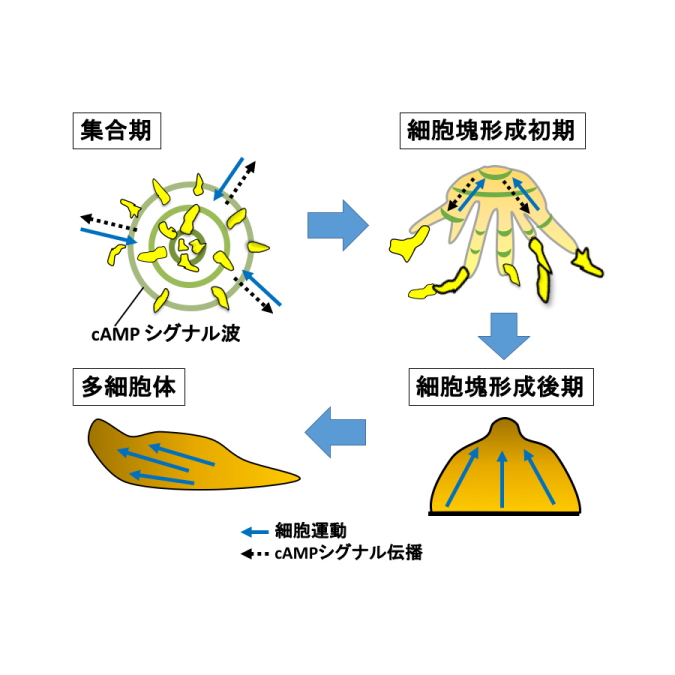
図1.飢餓状態の細胞性粘菌の発生機構。
(左上)細胞同士が走化性シグナルであるcAMPを伝播し合い、シグナル中心に向けて集合する。(右上)集まった細胞は細胞塊を形成する。細胞塊内でもcAMPシグナル伝播が続いている。(右下)細胞塊上部に突起ができ、上へと伸びる。(左下)伸びた細胞塊は組織的な運動を行う多細胞体を形成する。
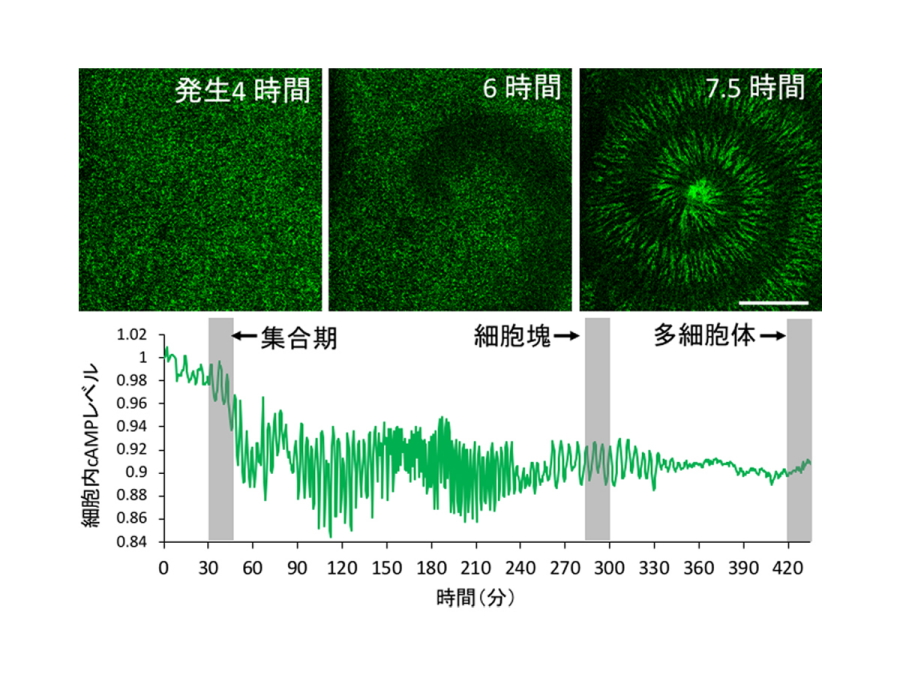
図2.細胞性粘菌cAMPリレーの蛍光イメージング。
(上段)発生開始から4~7.5時間における集団内でのcAMPリレーの伝播を捉えた蛍光像。暗い部分でcAMPリレーが伝播している。(下段)粘菌細胞集団の発生を通じたcAMPシグナルレベルの継時変化。
用語解説
- 細胞集団運動
運動する複数の細胞がまとまって集団を形成し、方向の揃った協調的な運動を見せる現象。動物の上皮細胞や胚発生時の器官形成などで見られる。 - 細胞間情報伝達
細胞集団内においてシグナルを受け取った細胞が別の細胞にさらにシグナルの受け渡しを行うことで情報を互いに伝達しあうこと。 - 細胞性粘菌
土壌中に生息する単細胞アメーバ。普段は単細胞生物として振舞うが、餌がなくなると細胞同士で集合して多細胞体となる。走化性運動や細胞集団運動を研究する上でのモデル生物として用いられている。 - 走化性
細胞が外部の誘因物質などの化学物質の濃度勾配を感知し、その勾配に沿って移動する性質のこと。白血球など免疫細胞が病原体を追跡し捕食する現象や、受精卵から個体が発生する現象など、様々な生命現象に関わっている。
| 原著論文 | Commun Biol (2019) |
|---|---|
| 論文タイトル | Collective Cell Migration of Dictyostelium Without cAMP Oscillations at Multicellular Stages |
| 著者 | Hidenori Hashimura (1, 2), Yusuke V Morimoto (2, 3), Masato Yasui (2), Masahiro Ueda (1, 2, 3, 4)
|
| PubMed | 30701199 |
