多能性細胞を安定して形成する仕組みの解明
発生運命の指定に伴う転写因子ネットワークの変化を同定
| 原著論文 | Development (2024) |
|---|---|
| 論文タイトル | Fate specification triggers a positive feedback loop of TEAD-YAP and NANOG to promote epiblast formation in preimplantation embryos |
| 研究室サイト | 初期胚発生研究室〈佐々木 洋 教授〉 |
概要
大阪大学大学院生命機能研究科の大学院生の廣野尚暉さん(博士課程)、佐々木洋教授らの研究グループは、マウス着床前胚において細胞分化のタイミングがばらついているにも関わらず多能性細胞(エピブラスト)が安定して作られる仕組みを明らかにしました。
これまで、着床前胚のエピブラスト形成過程について、エピブラスト細胞の発生運命の指定の仕組みと多能性を制御する転写因子の発現制御の仕組みが明らかにされていましたが、これらの仕組みが働くタイミングには細胞間でばらつきがあり、タイミングがばらつきながらもエピブラストが正しく分化するしくみは解明されていませんでした。
今回、佐々木教授らの研究グループは、着床前胚におけるエピブラスト細胞の分化過程を1細胞レベルで詳細に解析することにより、細胞集団としては個々の細胞の分化状態にばらつきがあるものの、個々の細胞レベルでは、発生運命の指定、標的遺伝子の変化、分化の安定化、などの一連の分化現象が順番に起こる仕組みが存在することで、正しいエピブラスト細胞の分化を可能にしていることを解明しました。ゆらぎやばらつきは様々な発生過程に存在するため、本研究の成果をもとに発生がばらつきながらも正確に起こる仕組みの理解が進むことが期待されます。
研究の背景
これまでの研究から、マウス着床前胚の胚盤胞期に内部細胞塊から多能性組織のエピブラストがつくられる過程では、個々の細胞の分化タイミングにばらつきがあることが知られていました。さらに、エピブラストの分化では、転写因子NANOGとGATA6が共に発現している状態からNANOG単独の発現になることでエピブラストへの発生運命が指定されること、またHippoシグナル経路の転写共役因子のYAPが細胞質から核へ移行することで転写因子TEADを活性化して多能性因子の発現を増加させることが分かっていました。しかし、これらの分化現象のタイミングには個々の細胞間でばらつきがあり、ばらつきのある中でなぜエピブラストが正しく分化できるのかは分かっていませんでした。
本研究の成果
佐々木教授らの研究グループでは、内部細胞塊からエピブラスト細胞が作られる過程の転写因子NANOG、GATA6と転写共役因子YAPのタンパク質の発現変化を胚の画像解析により1細胞レベルの詳細な定量的解析を行ない、NANOGによる発生運命の指定を受けた細胞でYAPの核移行によるTEADの活性化が起きていることを見出しました。さらに、胚操作・遺伝子操作などの方法により、NANOGの発現がTEADを活性化し、TEADの活性化はNANOGの発現を維持する、という正のフィードバックループが存在し、一旦発生運命が指定されるとエピブラストへの分化が安定に進む仕組みがあることもわかりました。
さらに、発生運命の指定の前後ではTEADの標的遺伝子の応答性が変化することも見出し、上記の仕組みでエピブラストに指定された細胞だけでTEADが活性化することにより、TEADが正しい標的遺伝子を活性化するようにしていることもわかりました。このように、細胞集団として見た時に細胞間で分化のタイミングにばらつきがあっても、個々の細胞では、発生運命の指定、標的遺伝子の変化、TEADの活性化、正のフィードバックによる分化の安定化、という一連の現象が順番に協調的に起こる仕組みが存在することで正しいエピブラスト細胞の分化を可能にしていることが明らかになりました。
研究成果のポイント
- 着床前胚で多能性細胞(エピブラスト)が安定して作られる仕組みを解明
- 着床前胚内の細胞分化のタイミングには細胞間でばらつきがあるが、分化を制御する複数の現象が順番に起こる仕組みが存在することで、個々の細胞が正しく分化することを見出した
- 様々な発生過程においてばらつきを克服するしくみの理解が進むことが期待される
本研究成果が社会に与える影響(本研究成果の意義)
ゆらぎやばらつきは様々な発生過程に存在するため、本研究の成果をもとに発生がばらつきながらも正確に起こる仕組みの理解が進むことが期待されます。
研究者のコメント
発生は様々な仕組みでゆらぎやばらつきを克服しています。本研究ではその1つの仕組みとして細胞自律的な細胞分化の仕組みの存在を示しました。今後は、その分子基盤の解明を進めるとともに、非細胞自律的な仕組みの解明についても取り組んでゆきたいと考えています。(佐々木洋)
特記事項
本研究成果は、2024年12月4日(水)(日本時間)に英国科学誌「Development」(オンライン)に掲載されました。
なお、本研究は、日本学術振興会科学研究費助成事業(JP19H04778、JP20H03261、JP21H05288)の支援を受けて行われました。
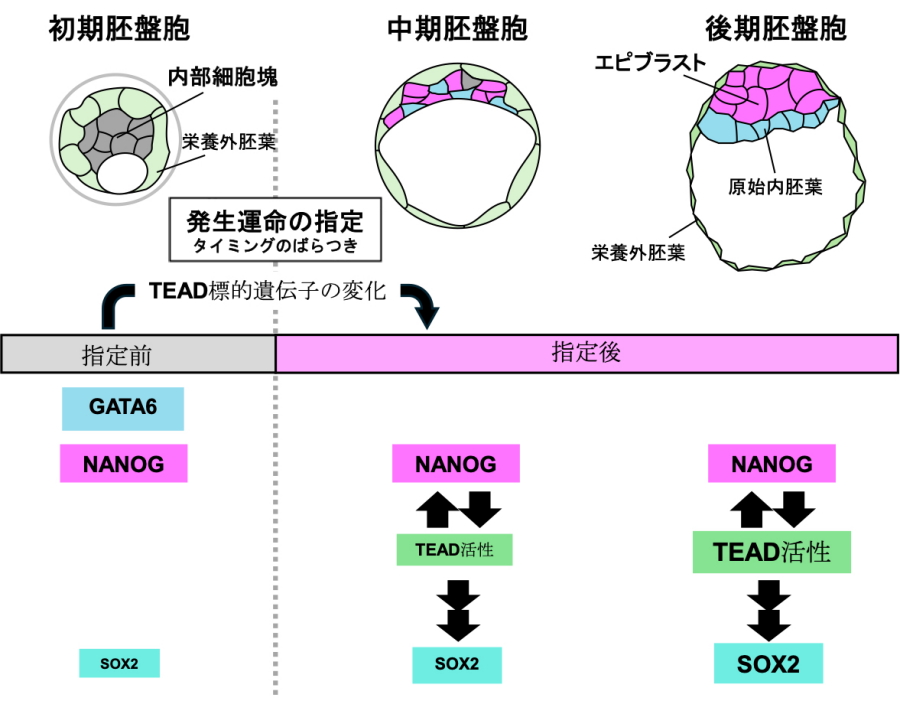
図.マウス着床前胚においてエピブラストが安定に分化するしくみ
(上)マウス着床前胚の胚盤胞期の発生。胚盤胞期の初期から後期にかけて内部細胞塊からエピブラストと原始内胚葉がつくられるが、その細胞分化(発生運命の指定)のタイミングには細胞間でばらつきがある。(下)エピブラスト細胞の分化を制御する転写因子ネットワーク。NANOGとGATA6が共発現している状態からNANOG単独発現になることでエピブラストへの発生運命が指定される。発生運命の指定に伴い、TEADの標的遺伝子が変化するとともに、NANOGはTEADを活性化し、TEADはNANOGの発現を維持することで正のフィードバックループが働きエピブラストの分化を安定に進める。TEADはSOX2の発現上昇にも必要である。
用語解説
- 多能性細胞
多能性細胞は体の全ての種類の細胞を作る能力を持つ細胞です。胚性幹細胞(ES細胞)や人工多能性細胞(iPS細胞)も多能性細胞です。 - エピブラスト
エピブラストは着床前の胚の中に作られる多能性細胞からなる組織です。 - 発生運命の指定
発生運命の指定とは胚の中の特定の細胞が、発生が進むとどの細胞になるのか、その方向が決まった状態を指します。 - 転写因子
転写因子は、核内に存在するタンパク質で、DNAの特定の遺伝子配列を認識して結合し、その近くに存在する遺伝子の発現を活性化したり抑制したりする働きを持っています。 - 胚盤胞期
マウスなどの哺乳類は着床前の発生により嚢胞状の形をした胚盤胞という構造を作り、子宮に着床します。胚発生過程の胚盤胞の時期を胚盤胞期と呼びます。胚盤胞の外側には、着床に必要で将来胎盤を構成する栄養外胚葉が存在し、内側に胚の体を作るエピブラストと胚体外組織を作る原始内胚葉が存在します。 - 内部細胞塊
内部細胞塊とは、初期の胚盤胞の内側に存在する細胞の塊のことを言います。初期胚盤胞から後期胚盤胞にかけて内部細胞塊が分化してエピブラストと原始内胚葉がつくられます。 - Hippoシグナル経路
Hippoシグナル経路は細胞間の接着などのシグナルによって活性化され遺伝子発現を抑制するシグナル伝達経路です。下流因子として転写因子のTEADと転写共役因子のYAPがあります。 - 転写共役因子
転写共役因子は核内で働くタンパク質で、転写因子と結合して転写因子を活性化したり抑制したりする働きをします。YAPは細胞質から核へ移行することで転写因子TEADと結合してTEADを活性化します。
| 原著論文 | Development (2024) |
|---|---|
| 論文タイトル | Fate specification triggers a positive feedback loop of TEAD-YAP and NANOG to promote epiblast formation in preimplantation embryos |
| 著者 | Naoki Hirono (1), Masakazu Hashimoto (1, 2), Hiromi Shimojo (1), Hiroshi Sasaki (1)
|
| PubMed | 39629521 |
