免疫細胞を多く造る造血幹細胞を増やすための生理活性物質の特定
加齢による免疫能の低下抑制や再生医療への貢献に期待
| 原著論文 | Nat. Commun. 14(1):6402 (2023) |
|---|---|
| 論文タイトル | Ebf3+ niche-derived CXCL12 is required for the localization and maintenance of hematopoietic stem cells |
| 研究室サイト | 幹細胞・免疫発生研究室〈長澤 丘司 教授〉 |
概要
大阪大学大学院生命機能研究科の中谷泰治さん(幹細胞・免疫発生)(研究当時:生命機能研究科博士後期課程)、長澤丘司教授(大学院医学系研究科/大学院生命機能研究科/免疫学フロンティア研究センター)らの研究グループは、骨髄で造血幹細胞ニッチを構成するCAR細胞が産生するケモカインCXCL12が免疫細胞(B細胞)を多く造る幹細胞をニッチ細胞に引き寄せ、増やし、免疫細胞を十分な数だけ維持していることを世界で初めて明らかにしました。これまで、骨髄で血液細胞を生み出している造血幹細胞の中には、免疫細胞を多く造る細胞が存在し、これが年をとると減少し、免疫力の低下の一因となっていると考えられていますが、これを生体内で維持する仕組みは不明でした。
今回、研究グループは、骨髄で血液細胞を造る司令塔となっている細胞でCXCL12を欠損させ、造血幹細胞の性質を解析することにより、CXCL12の造血幹細胞と免疫細胞における新たな役割を解明しました。今後、これらの成果を基盤に、加齢による免疫能の低下を抑制し、免疫細胞を十分に生み出せる造血幹細胞を培養して再生医療に用いる技術の開発が期待されます。
研究の背景
病原体を排除する免疫細胞や骨髄球(自然免疫細胞)を含む白血球や、酸素を全身に運搬する赤血球などの血液細胞は、骨髄という骨の中心部分にあいた空間で、造血幹細胞(HSC)という血液細胞の一種から生涯にわたって生み出されています。造血幹細胞は、骨髄でCAR細胞という特別な支持細胞と接着し、CAR細胞が産生するCXCL12やSCFなどのサイトカインによって、細胞数が維持されています。
造血幹細胞は、どの細胞も同じ性質を持つと考えられていましたが、近年、免疫細胞を沢山造る造血幹細胞(Ly-HSC)と、少ししか造らない造血幹細胞(My-HSC)が両方存在することがわかってきました。年をとると免疫能が低下し、新型コロナウイルスなど病原体の感染で重症化すると考えられていますが、老齢マウスでLy-HSCが減ってゆくことから、これが免疫能の低下に重要ではないかと考えられています。したがって、高齢者の免疫能を強化するためには、Ly-HSCを増やすことが大切ですが、Ly-HSCを維持、増加させる仕組みは不明でした。
本研究の成果
研究グループは、薬剤の投与でCXCL12遺伝子の欠損を誘導でき、正常なCAR細胞とCXCL12を欠損するCAR細胞を組織学的に区別できるマウスを作成しました。このマウスで約半数のCAR細胞でCXCL12を欠損させたところ、造血幹細胞の数は変化ありませんでしたが、その大部分は、CXCL12を欠損したCAR細胞ではなく、正常なCAR細胞と接着していました(図2A、B)。これはCXCL12を欠損したCAR細胞の近くから正常なCAR細胞の近くに造血幹細胞が移動したことを示します。この結果から、骨髄内でCXCL12が造血幹細胞をCAR細胞に引き寄せることがわかりました。
そこで次に、全てのCAR細胞で特異的にCXCL12を欠損させたマウスを解析したところ、骨髄の造血幹細胞、免疫細胞とその前駆細胞(幼若な細胞)、骨髄球とその前駆細胞、赤血球とその前駆細胞など血液細胞が著減していました(図2C)。またこのマウスの造血幹細胞を野生型マウスに移植し血液細胞を産生する能力を解析したところ、骨髄球前駆細胞の産生能と比較して、免疫細胞(B細胞)前駆細胞の産生能が著しく低下していました(図2D)。造血幹細胞の最新の無血清培養では、Ly-HSCを十分維持できませんが、CXCL12を添加すると維持できるようになりました。
以上より、CAR細胞が産生するCXCL12が骨髄内で造血幹細胞を誘引し、造血幹細胞、特に免疫細胞をより多く産生する造血幹細胞の維持に必須の役割を果たすことが示されました。B細胞の産生に必須のサイトカインは、B細胞前駆細胞の増殖を促進すると考えられていましたが、特定の造血幹細胞に作用してB細胞の産生を促進する新しい仕組みが明らかになりました。
研究成果のポイント
- マウスでCAR細胞の約半数でケモカインCXCL12を欠損させたところ、造血幹細胞の数は変化しなかったが、その大部分は、CXCL12欠損CAR細胞を離れ、正常なCAR細胞に接着した。
- 全てのCAR細胞でCXCL12を欠損させたマウスでは、骨髄の造血幹細胞、免疫細胞が著減しており、造血幹細胞は、骨髄球の産生能より、免疫細胞(B細胞)の産生能が著しく低下していた。
- 造血幹細胞の最新の無血清培養では、免疫細胞を沢山造る造血幹細胞(Ly-HSC)を十分維持できなかったが、CXCL12を添加すると維持できるようになった。
- 研究成果は、加齢による免疫能の低下を抑制し、免疫細胞を十分生み出せる造血幹細胞を培養し、再生医療に用いるための基盤となる。
本研究成果が社会に与える影響(本研究成果の意義)
加齢により免疫能が低下する仕組みは、十分明らかになっていません。加齢に伴い、造血幹細胞に備わっている「免疫を担う免疫細胞を生み出す能力」が低下することがわかってきましたが、その仕組み(分子機構)は不明でした。本研究成果を基盤として、加齢による免疫能の低下を抑制することが可能になることが期待されます。一方、造血幹細胞を注射し、免疫細胞を含む血液細胞を再生する医療(骨髄移植)は、抗がん剤投与による副作用から命を守る医療として広く用いられており、将来は、血液細胞の遺伝子異常に対する医療として注目されています。その際、造血幹細胞を培養して増やせば、提供者の負担が軽減し、適用も広がります。現在の培養方法では、Ly-HSCを必ずしも十分に増やせませんが、本研究成果を基盤として、免疫細胞を十分生み出せる造血幹細胞を培養で増やして骨髄移植に用いる医療応用にも期待が持てます。
特記事項
本研究成果は、2023年10月25日(水)18時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
なお、本研究は、文部科学省日本学術振興会科学研究費助成事業(18H03998、17H05643、19K08837、22H05064、22H02850)などの支援により行われました。
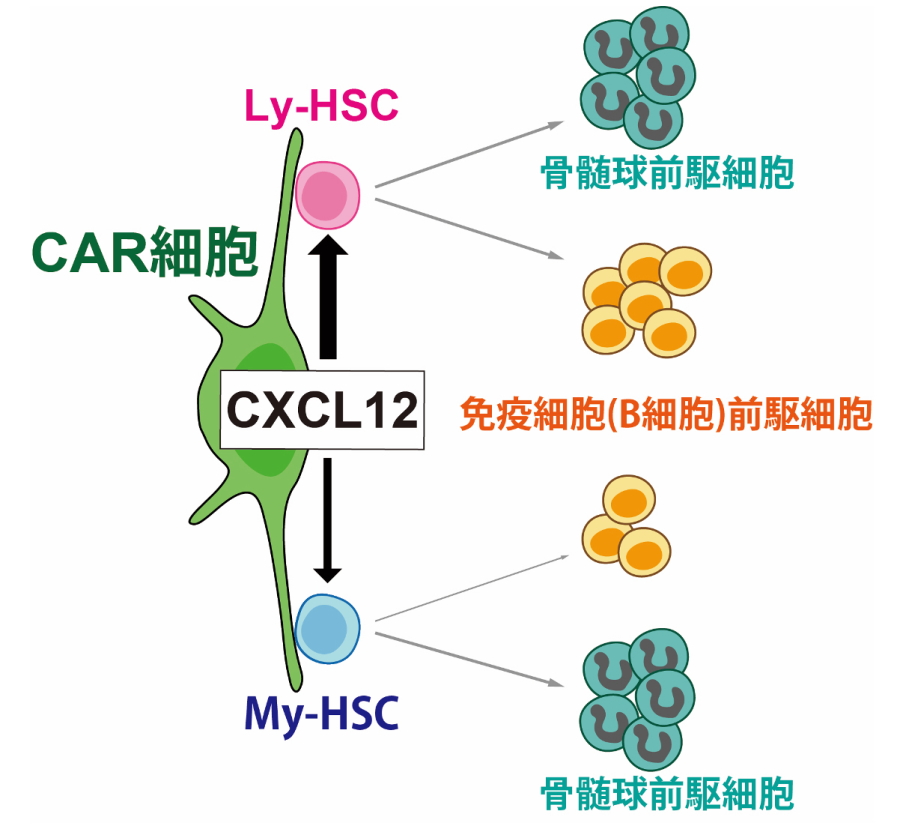
図1.CAR細胞が造血幹細胞を維持する機構
CAR細胞が産生するCXCL12はLy-HSCを維持する。
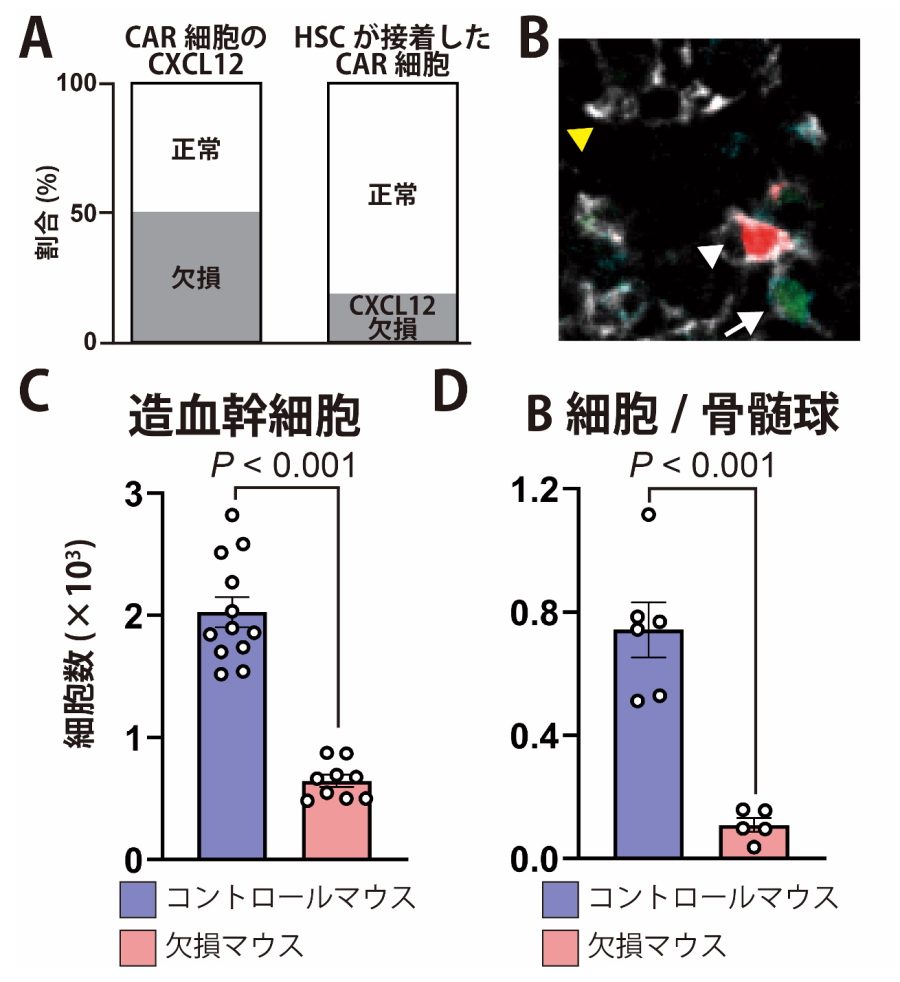
図2.CAR細胞は造血幹細胞を誘引し、Ly-HSCを維持する
(A)正常およびCXCL12欠損CAR細胞の割合(左)と、それらのCAR細胞に接着したHSCの割合(右)。(B)正常なCAR細胞(白矢頭)、CXCL12欠損CAR細胞(黃矢頭)、造血幹細胞(矢印)の局在。(C)CAR細胞でCXCL12を欠損したマウスの造血幹細胞数。(D)造血幹細胞が産生するB細胞前駆細胞と骨髄球前駆細胞の比。
用語解説
- 造血幹細胞ニッチ
造血幹細胞が接着し、その維持に必須の限局した環境(場所)。 - CAR細胞
造血幹細胞と造血のニッチを構成する中心的な細胞で、CXCL12、SCFを高発現する長い細胞突起を持つ細網細胞で、長澤教授らによって特定された。CAR細胞は、血液細胞を育てると共に、その一部は、骨芽細胞や脂肪細胞に分化する骨髄特有の細胞である。(参照:https://www.fbs.osaka-u.ac.jp/ja/research_results/papers/detail/153) - ケモカイン
システイン残基の位置を含む構造が類似した約100アミノ酸からなるサイトカインのファミリー。 - CXCL12
ケモカインファミリーに属するサイトカインで、胎児期の造血幹細胞の骨髄への移動・定着に必須で、成体では造血幹細胞の骨髄での維持、B細胞の産生、胃腸に分布する動脈の形成に必須。 - B細胞
病原体を排除する蛋白質である抗体を産生する代表的な免疫細胞。 - 造血幹細胞
生涯に渡って自己複製(自分と同じ細胞を生み出すこと)でき、大部分の種類の血液細胞を生み出す能力がある細胞。 - サイトカイン
細胞の外に存在し、細胞表面にある受容体と結合し、細胞の増殖や分化や運動を調節する蛋白質。
| 原著論文 | Nat. Commun. 14(1):6402 (2023) |
|---|---|
| 論文タイトル | Ebf3+ niche-derived CXCL12 is required for the localization and maintenance of hematopoietic stem cells |
| 著者 | Taichi Nakatani (1, 2, 3), Tatsuki Sugiyama (1, 2, 3), Yoshiki Omatsu (1, 2, 3), Hitomi Watanabe (4), Gen Kondoh (4), Takashi Nagasawa (1, 2, 3)
|
| PubMed | 37880234 |
