ヒト中耳真珠腫で骨破壊を促す線維芽細胞を発見
骨が壊れる仕組みを解明!手術以外の治療への扉を開く
| 原著論文 | Nat. Commun. (2023) |
|---|---|
| 論文タイトル | Single-cell transcriptomics of human cholesteatoma identifies an activin A-producing osteoclastogenic fibroblast subset inducing bone destruction |
| 研究室サイト | 免疫細胞生物学研究室〈石井 優 教授〉 |
概要
大阪大学大学院医学系研究科の清水康太郎特任研究員(非常勤)、菊田順一准教授、石井優教授(免疫細胞生物学)、猪原秀典教授(耳鼻咽喉科・頭頸部外科学)らの研究グループは、中耳真珠腫という耳の骨が破壊される難病において、アクチビンA(Activin A)というタンパク質を介して骨の破壊を誘導する、新たな病原性線維芽細胞を世界で初めて同定しました。
中耳真珠腫は骨を破壊しながら増大する疾患で、時に聴こえや平衡感覚を感じ取る内耳を破壊します。日本国内では10万人に約10人の患者がいると推定され、現在の治療法は手術のみです。どうして骨が壊れていくのかについては未だ解明されていません。
今回、研究グループは、患者さんから手術時に摘出した中耳真珠腫に対してシングルセルRNAシークエンス解析を行いました。その結果、中耳真珠腫の組織内にはアクチビンAというタンパク質を産生する線維芽細胞が存在し、骨を壊す破骨細胞の分化を促進することにより骨破壊が誘導されることを解明しました。これにより、線維芽細胞が産生するアクチビンAの阻害が中耳真珠腫の治療候補となり得ることが分かり、これまで手術のみが唯一の治療であった中耳真珠腫に、薬剤を用いた新たな保存的治療の選択肢が増えることが期待されます。
研究の背景
中耳真珠腫は音を伝える鼓膜から発生し、音を感じ取る蝸牛やバランスを感じ取る前庭などの重要な器官を守る側頭骨を破壊しながら増大する疾患です。時に重篤な症状を引き起こす疾患ですが、今なお中耳真珠腫が骨を壊すメカニズムについては明らかになっていません。
本研究の成果
今回、研究グループは、患者さんから手術の際に摘出した中耳真珠腫に対して、一細胞毎のRNA配列を読み取る「シングルセルRNAシークエンス解析」を行いました。その結果、中耳真珠腫の線維芽細胞はアクチビンAというタンパク質を産生しており、その中でも特に過剰にアクチビンAを産生する新たな線維芽細胞が存在することを発見しました。また、アクチビンAは骨を壊す破骨細胞を誘導することが分かりました。さらに、中耳真珠腫モデルマウスを用いた実験において、線維芽細胞のアクチビンAの産生を抑制すると、骨を壊す破骨細胞の数が減少することが明らかとなりました。
研究成果のポイント
- ヒト中耳真珠腫組織をシングルセル解析し、骨破壊型の線維芽細胞を発見した。
- 中耳真珠腫で骨が壊れる仕組みは不明だったが、骨を破壊する特殊な線維芽細胞が出現し、破骨細胞を誘導することにより骨破壊が起こることが判明した。
- 従来、中耳真珠腫の治療法は手術のみであったが、骨破壊の仕組みが明らかになったことで、薬剤による新たな保存的治療法の開発が期待される。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、線維芽細胞が産生するアクチビンAの阻害が、中耳真珠腫の治療候補となり得ることが分かりました。現在の中耳真珠腫の有効な治療法は手術のみであるが、今後、薬剤により中耳真珠腫を保存的に治療する新たな選択肢が増えることが期待されます。さらに、特殊な線維芽細胞による骨破壊誘導メカニズムが明らかになったことで、関節リウマチなど中耳真珠腫以外の骨が破壊される疾患の解明と新規治療法の開発にも貢献できると期待されます。
研究者のコメント
関節リウマチやがんの骨転移など、骨が壊される病気はたくさんありますが、中耳真珠腫は耳の中の骨が壊される難病です。これまで原因も不明であり、手術しか治療法がなかったのですが、今回の研究成果によって、新しい治療薬の開発が進むことが期待され、この病気の患者さんには大きな福音といえるかもしれません。(石井優)
特記事項
本研究成果は、2023年8月3日(木)18時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
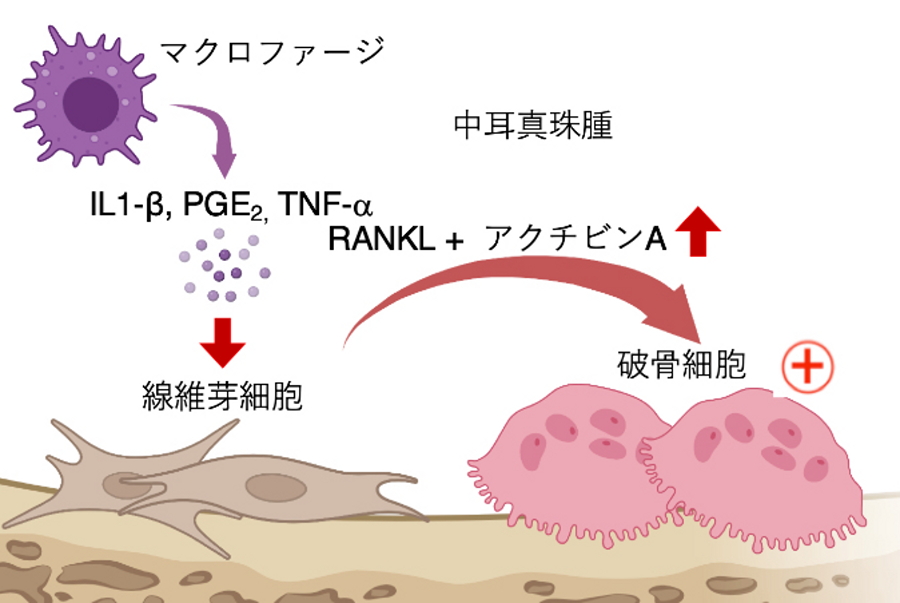
中耳真珠腫では、炎症性サイトカインによって線維芽細胞のアクチビンA産生量が増加し、破骨細胞分化が促進することで、骨が破壊される。
用語解説
- アクチビンA(Activin A)
細胞の増殖および分化の調節、神経細胞の生存など、様々な生物活性を有する分泌性タンパク質(サイトカイン)で、トランスフォーミング増殖因子β(TGF-β)ファミリーに分類される。INHBA遺伝子にコードされたinhibin subunit beta Aが2つ結合したホモダイマーの構造である。中耳真珠腫の線維芽細胞以外に、脳や肝臓、性腺など多くの臓器・細胞からも産生される。 - 線維芽細胞
コラーゲン・エラスチンなどの結合組織を産生する細胞で、皮膚真皮をはじめ様々な臓器に存在する。癌や関節リウマチ、歯周病など様々な疾患に関連する線維芽細胞も存在する。 - シングルセルRNAシークエンス解析
一つの細胞に含まれるメッセンジャーRNAからcDNAを作成し、増幅した後に次世代シークエンサーを用いてRNA配列を読み取ることで、全遺伝子の発現量を細胞毎に定量解析する手法。
| 原著論文 | Nat. Commun. (2023) |
|---|---|
| 論文タイトル | Single-cell transcriptomics of human cholesteatoma identifies an activin A-producing osteoclastogenic fibroblast subset inducing bone destruction |
| 著者 | Kotaro Shimizu (1, 2, 3), Junichi Kikuta (1, 2, 4), Yumi Ohta (3), Yutaka Uchida (1, 2), Yu Miyamoto (1, 2), Akito Morimoto (1, 2), Shinya Yari (1, 2), Takashi Sato (3), Takefumi Kamakura (3), KazuoOshima (3), Ryusuke Imai (3), Yu-Chen Liu (5, 6), Daisuke Okuzaki (5, 6), Tetsuya Hara (7), Daisuke Motooka (5, 6), Noriaki Emoto (7), Hidenori Inohara (3), Masaru Ishii (1, 2, 4)
|
