遺伝子発現の最適化、核膜で
核膜タンパク質による新たな遺伝子発現調節機構を発見!
| 原著論文 | Nat. Struct. Mol. Biol. 29, 910–921 (2022) |
|---|---|
| 論文タイトル | The inner nuclear membrane protein Lem2 coordinates RNA degradation at the nuclear periphery |
| 研究室サイト | 細胞核ダイナミクス研究グループ〈平岡 泰 招へい教授〉 |
概要
大阪大学大学院生命機能研究科の平野泰弘特任講師(常勤)、当時大学院生の衣笠泰葉博士(現医薬基盤・健康・栄養研究所研究員)、平岡泰名誉教授らの研究グループは、ドイツのルートヴィヒ・マクシミリアン大学ミュンヘンのSigurd Braun博士らの国際研究グループと共同で、ノンコーディングRNAの細胞核内での新規分解経路にLem2と呼ばれる核膜タンパク質が関わることを世界で初めて明らかにしました。
細胞は生命の設計図であるDNA(デオキシリボ核酸)をもとに、様々な機能を持つタンパク質を作ることで生命活動を行っています。この過程で、DNAの情報はRNA(リボ核酸)に変換(転写)されますが、ノンコーディングRNAと呼ばれるタンパク質をコードしないRNAが存在することが知られていました。ノンコーディングRNAが細胞核中に蓄積するとゲノムの不安定化を引き起こしてしまうため、常に分解されているのですが、どのようにノンコーディングRNAが速やかに分解されるのかは分かっていませんでした。
今回、分裂酵母をモデルとして解析を行った結果、ノンコーディングRNAが核膜に運ばれることで速やかに分解されることが分かりました。また、核膜にノンコーディングRNAが集まるためには、核膜タンパク質Lem2が必要であることを見出しました。このような分解を受けるノンコーディングRNAの中には、生殖細胞である精子や卵子を作る際に行われる減数分裂と呼ばれる特殊な細胞分裂において重要な働きをするものも含まれていました。今回発見したRNAの分解因子は分裂酵母だけでなくヒトでも保存されており、Lem2と共に働くことも分かりました。したがって、今回明らかになった知見は将来的に不妊治療の進展にも寄与することが期待されます。
研究の背景
細胞は遺伝情報であるDNA(デオキシリボ核酸)を設計図に、様々な機能を持つタンパク質を作ることで生命活動を行っています。この過程でDNAの情報はRNA(リボ核酸)に変換(転写)されたのち、タンパク質となります。このようにタンパク質をコードするRNAはコーディングRNAと呼ばれます。一方で、タンパク質をコードしないDNAからもRNAが作られていることも知られており、このようなRNAはノンコーディングRNAと呼ばれています。ノンコーディングRNAの機能は一部のケースを除いてほとんど分かっていませんが、細胞核中に蓄積するとゲノムの不安定化を引き起こしてしまうことがあります。そのため、ノンコーディングRNAは常に分解され、量がコントロールされていますが、ノンコーディングRNAだけが速やかに分解される仕組みはこれまで分かっていませんでした。
本研究の成果
核膜タンパク質は核膜に染色体 をつなぎ止め、ヘテロクロマチンと呼ばれる転写不活性化な染色体領域を形成することが知られています(図1)。研究グループでは、これまでこの分子機構の解析を進めており、核膜タンパク質Lem2が転写の不活性化に重要な役割を果たすことを見出していました。
そこで今回、Lem2がどのような遺伝子の転写を調節しているかを調べるため、lem2遺伝子を破壊した分裂酵母細胞を作成し、RNA-seqと呼ばれる方法を用いて、lem2遺伝子破壊細胞内のRNA量を網羅的に解析しました。すると、多くのノンコーディングRNAのRNA量が上昇していました(図2)。上昇が見られたノンコーディングRNAの特徴を抽出したところ、減数分裂の進行に重要な働きを持つものが多数含まれていることが分かりました。
ところが、解析を進めると、当初の予想と異なり、Lem2が転写の不活性化ではなく、一旦転写されたRNAの分解を促進することでノンコーディングRNA量を調節していることが分かりました。ノンコーディングRNAの分解は、エキソソームと呼ばれるタンパク質複合体が担っています。DSRという特殊な分解標識配列を持ったノンコーディングRNAはMmi1というRNA結合タンパク質を介してMTRECと呼ばれるタンパク質複合体に取り込まれ、エキソソームに運ばれていきます。Lem2はMTRECの構成因子であるRed1に結合し、RNAを効率的にエキソソーム複合体に渡す役割を持つことが分かりました(図3)。次に、この時分解されるノンコーディングRNAが核内でどのようにふるまうかを蛍光顕微鏡で観察しました。野生型の細胞では、ノンコーディングRNAは核膜に集積しており、Lem2が無くなると核膜から離れたことから、ノンコーディングRNAが核膜に運ばれることが分解の促進に必要となることも分かりました(図4)。
今回の研究で得られた成果は、核膜で行われる新たな遺伝子発現調節様式を明らかにしたもので、画期的な成果と言えます。
研究成果のポイント
- ノンコーディングRNAは核膜に集積することで速やかに分解される
- この集積には核膜タンパク質Lem2が関与
- Lem2は、DSRと呼ばれる配列を持つノンコーディングRNAを、MTREC複合体に受け渡すことでエキソソームを介したRNAの分解促進に関与
- この分解は精子や卵子を作る減数分裂の進行に必須なノンコーディングRNAにも起こっていたことから、将来の生殖医療の進展にも期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、核膜タンパク質の新たな遺伝子発現調節機構が明らかになりました。今回発見した分解様式で分解を受けるノンコーディングRNAの中には、生殖細胞である精子や卵子を作る際に行われる減数分裂と呼ばれる特殊な細胞分裂において重要な働きをするものも含まれていました。すなわち、今回発見した遺伝子発現調節によって減数分裂の進行も制御されている可能性が示唆されます。また、ヒトのLem2とRed1ホモログでも結合が見られたことから、ヒトでも同様のRNA分解機構が働いていることが推測されます。よって、今回明らかになった知見は将来的に不妊治療の進展にも寄与することが期待されます。
研究者のコメント
研究を行っていると思ってもみないところから新しいことが見つかってきます。今回の研究も、研究開始当初に予想したことが(残念ながら?)全く裏切られ、その代わりに新しい遺伝子発現調節機構を見つけることができました。サイエンスはこれだからオモロイと思います。また、今回の研究は、国際会議の時にbraun博士のグループとお互いの未発表データを議論しているときに同じ現象を見ていることに気づき、共同研究に発展しました。論文投稿直前から、コロナウイルス感染症の流行のために長い時間が必要となりました。オンラインツールが発達した現在でも、顔を突き合わせて議論することの重要さを感じています。(平野泰弘)
特記事項
本研究成果は、2022年9月19日(月)に英国科学誌「Nature Structural & Molecular Biology」(オンライン)に掲載されました。
なお、本研究は、日本学術振興会科学研究費助成事業学術変革領域(A)「生きた細胞や組織における散乱・揺らぎ計測と制御(研究分担者:平野泰弘)」、基盤研究(C)「極長鎖脂肪酸合成における核膜タンパク質Lem2-Bqt4の役割(研究代表者:平野泰弘)」、研究活動スタート支援「核膜タンパク質Lem2・Lnp1による核膜構造制御機構の解析(研究代表者:衣笠泰葉)」、挑戦的研究(萌芽)「ゲノムの安定性維持における超長鎖脂肪酸の役割に関する研究(研究代表者:平岡泰)」、新学術領域研究「減数分裂における細胞核・クロマチン構造の変換メカニズム(研究代表者:平岡泰)」の一環として行われました。
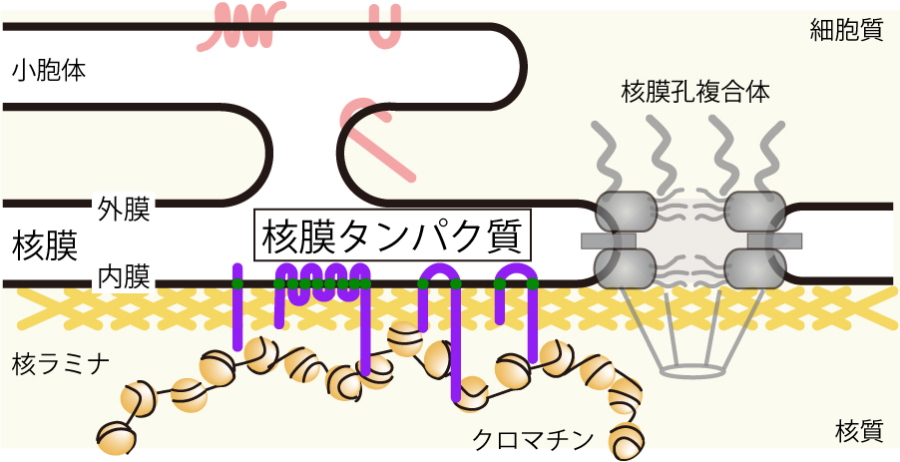
図1.核膜の模式図
核膜は脂質二重膜が二層(外膜・内膜)になった構造で、外膜は小胞体と連続している。この脂質膜には核内外の物質輸送に関わる核膜孔複合体が存在する。核膜内膜に特異的に存在する核膜タンパク質は染色体クロマチンを核膜につなぎ止め、転写が不活性なヘテロクロマチンを形成することで遺伝子の発現を制御している。
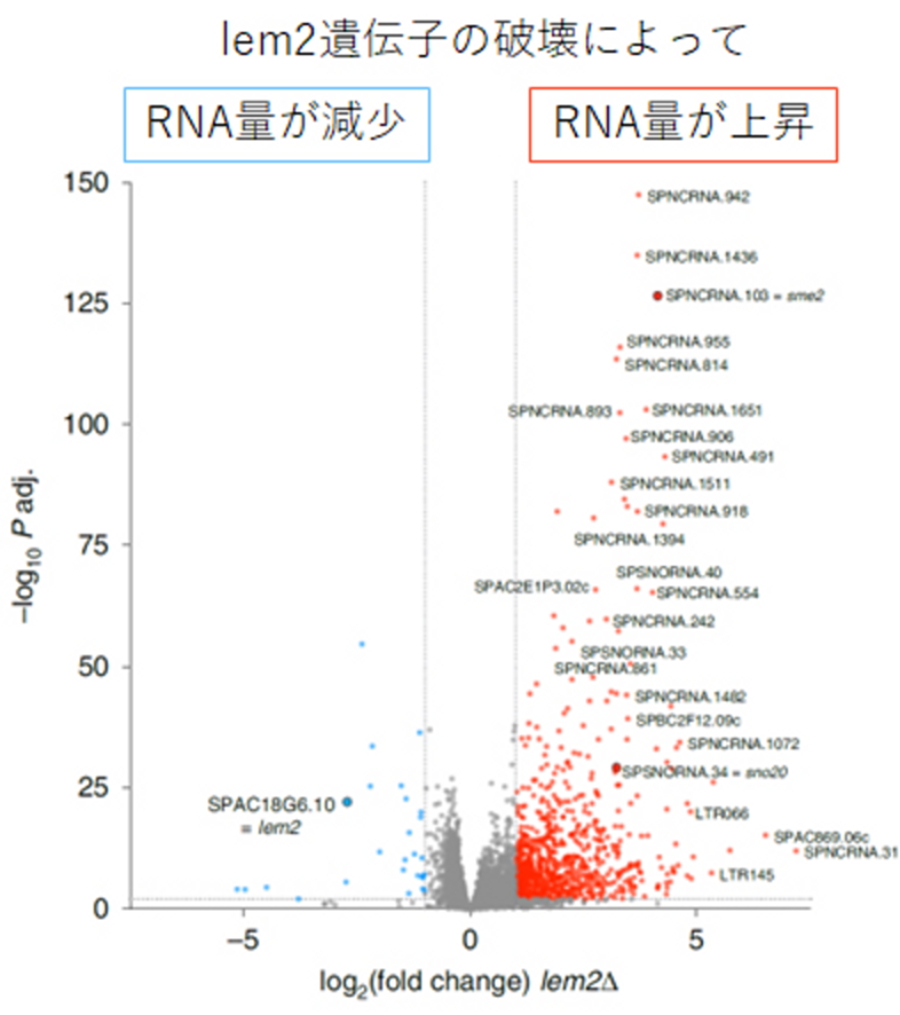
図2.lem2遺伝子破壊株のRNA量の網羅的解析
横軸は野生型と比較したときのRNAの変化量。0に近いほど変化が少なかったことを示している。縦軸は測定の確からしさ。赤色、水色の点はそれぞれRNA量が有意に上昇もしくは減少した遺伝子を示す。lem2遺伝子の破壊によって多数のノンコーディングRNAの量が上昇していた。
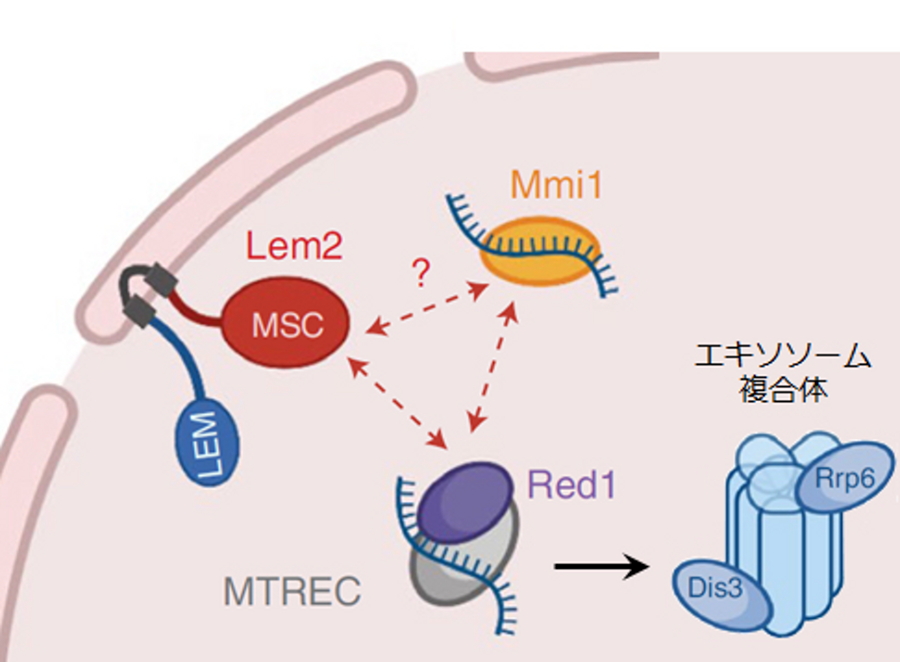
図3.Lem2がノンコーディングRNAの分解を促進する分子機構のモデル
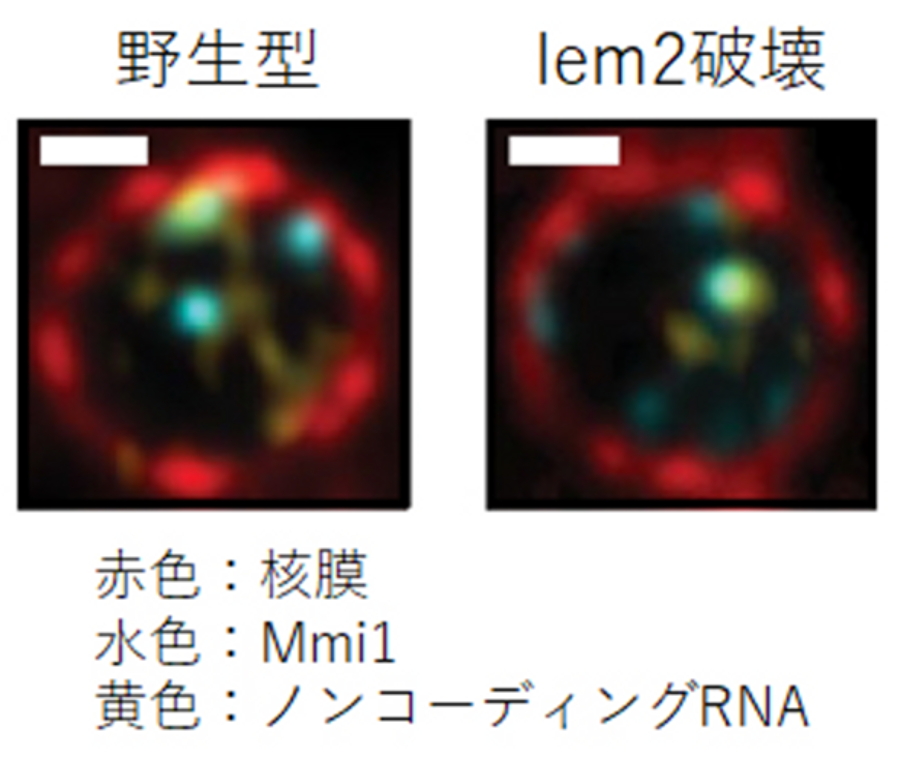
図4.ノンコーディングRNAの核内局在
核膜、ノンコーディングRNA、ノンコーディングRNAのDSR配列を認識するMmi1をそれぞれ赤、黄、水色で蛍光標識し、顕微鏡で観察した。野生型ではノンコーディングRNAとMmi1が核膜に結合しているが(左)、lem2遺伝子を破壊すると、その結合が見られなくなった(右)。
用語解説
- ノンコーディングRNA
遺伝情報であるDNAはRNAに転写される。RNAに変換された情報は、リボソームによってタンパク質に変換される。このようなタンパク質をコードするRNAがコーディングRNAと呼ばれるのに対し、タンパク質をコードしないRNAをノンコーディングRNAと呼ぶ。 - 核膜
真核生物の核を細胞質から隔てている生体膜で、遺伝物質を内包しており、内膜と外膜からなる二重の脂質二重層構造から成る。 - Lem2
核膜タンパク質の一種。二回膜貫通型の膜タンパク質で、ヒトから繊毛虫テトラヒメナに至るまで広く保存されている。様々な機能を持つ多機能タンパク質であることが報告されている。 - DSR
determinant of selective removalの略。ノンコーディングRNAの分解指標。UNAAACという6塩基のRNA配列からなり、Mmi1というRNA結合タンパク質によって認識される。 - MTREC複合体
Mtl1-Red1 coreの略で、NURS(nuclear RNA silencing)とも呼ばれる。RNAヘリカーゼであるMtl1とジンクフィンガータンパク質Red1(RNA elimination defective 1)からなるタンパク質複合体。 - エキソソーム
Rrp6、Dis3(Rrp44)の二つの3’→5’エキソリボヌクレアーゼ活性を持つタンパク質を含むタンパク質複合体で、ノンコーディングRNA分解を行う。Iss10と呼ばれるタンパク質が、ノンコーディングRNAとMTREC複合体の結合を仲介し、MTREC複合体のRed1とRrp6が結合することで、分解するRNAを受け取っている。 - 減数分裂
生殖に必要な配偶子(精子や卵子など)を形成する際に行われ、生じた配偶子では染色体数が分裂前の細胞の半分になる。 - ゲノム
遺伝子(gene)と集合を表す-omeを組み合わせた言葉で、細胞が持つ全遺伝子を表す。 - 分裂酵母
ヒトと同じ真核生物に属する単細胞生物で、自己の増殖や減数分裂という生き物としての根幹に関わるメカニズムの多くはヒトと分裂酵母の間で保存されている。 - 染色体
遺伝情報を担うDNAとタンパク質の構造体。ヒトの細胞では、父親と母親に由来する23組46本の染色体をもつことが知られている。本研究で利用した分裂酵母は染色体を3本しか持たない。 - RNA-seq
細胞内のRNAの配列情報を網羅的に解読する方法。RNAの配列情報だけでなく、同じRNA配列が何回読まれたかを解析することで、細胞内のRNA量を定量することができる。
| 原著論文 | Nat. Struct. Mol. Biol. 29, 910–921 (2022) |
|---|---|
| 論文タイトル | The inner nuclear membrane protein Lem2 coordinates RNA degradation at the nuclear periphery |
| 著者 | Lucía Martín Caballero (1, 2), Matías Capella (1, 3), Ramón Ramos Barrales (1, 4), Nikolay Dobrev (5, 6), Thomas van Emden (1, 2), Yasuhiro Hirano (7), Vishnu N Suma Sreechakram (1, 8), Sabine Fischer-Burkart (1), Yasuha Kinugasa (7, 9), Alicia Nevers (10, 11), Mathieu Rougemaille (10), Irmgard Sinning (5), Tamás Fischer (5, 12), Yasushi Hiraoka (7), Sigurd Braun (1, 2, 8)
|
| PubMed | 36123402 |
