iPS細胞から作った軟骨様髄核により椎間板を再生
椎間板変性に伴う腰痛疾患を治療しうる新技術
| 原著論文 | Biomaterials 284:121491 (2022) |
|---|---|
| 論文タイトル | Human iPS cell-derived cartilaginous tissue spatially and functionally replaces nucleus pulposus |
| 研究室サイト | 組織生化学研究室〈妻木 範行 教授〉 |
概要
大阪大学大学院医学系研究科の大学院生の釜谷崇志さん(研究当時)(整形外科学/京都大学iPS細胞研究所(CiRA)臨床応用研究部門)、萩澤宏樹さん(整形外科学/CiRA臨床応用研究部門)、海渡貴司准教授(整形外科学)、妻木範行教授(組織生化学/大阪大学大学院生命機能研究科/CiRA臨床応用研究部門)らの研究グループは、ヒトiPS細胞から作った軟骨様髄核組織を、脊椎の髄核を摘出した動物モデルに移植することにより椎間板変性を防げることを明らかにしました。
椎間板にある髄核の変性や消失は、腰痛に代表される腰椎疾患の原因となります。傷んだ髄核は自然には治らないため、再生治療が期待されていますが、移植して髄核の代わりをする、即ち置換するような組織はありませんでした。
今回、研究グループは、髄核と軟骨の遺伝子発現を、単一細胞レベルで網羅的に調べることにより、髄核の中の軟骨様髄核組織の性質を明らかにしました。そして、ヒトiPS細胞を分化誘導することによって、遺伝子発現プロファイルが軟骨様髄核組織に似た組織を用意しました。このヒトiPS細胞に由来する軟骨様髄核組織を、動物モデルに移植すると、椎間板の変性を防ぐことができました(図1)。移植組織は生着し、正常椎間板に近い力学特性を示したことから、髄核を置換する役割を果たしたことを示唆します。
これらの実験結果は、椎間板変性を原因とする腰椎疾患に対してiPS細胞由来軟骨様髄核組織を移植することにより、椎間板変性に起因する脊椎運動機能の回復と痛みの軽減をもたらす再生治療の開発に貢献することが期待されます。
研究の背景
髄核は椎間板の中心部分を構成する組織で、脊椎にクッション性と可動性を与えます。髄核の変性・消失は腰痛の原因になり、変性した髄核は治りません。細胞移植による再生治療法の開発が期待されていますが、髄核を置換するような組織を再生することはできませんでした。
本研究の成果
研究グループでは、ヒトと同じ霊長類であるサルの髄核と軟骨の遺伝子発現をシングルセルRNAシーケンスの方法を使って単一細胞レベルで網羅的に調べました。その結果、髄核は軟骨様組織と脊索様組織で構成されることが転写発現レベルで明らかになりました。そして、ヒトiPS細胞から軟骨様髄核に相当する組織(hiPS-Cart)を作り出し、椎間板変性をおこすラット動物モデルにおいて、髄核が失われた部分に移植しました。移植したヒトhiPS-Cartは少なくとも6ヶ月の長期にわたって生着し、椎間板の変性を防ぐことが明らかになりました。力学試験により、移植組織は正常椎間板に近い力学特性を持つことがわかりました。さらに、移植後にもシングルセルRNAシーケンス解析を行うことにより、hiPS-Cartは椎間板に移植された後に、椎間板の低酸素環境に順応した細胞分化をすることがわかりました。
これまでの移植物と異なり、hiPS-Cartは細胞外マトリックスを含むため、細胞の生存と分化が可能になったと考えます。その結果、hiPS-Cartは生着して髄核の機能を果たし、髄核を置換する組織を再生しました。
研究成果のポイント
- iPS細胞を使った椎間板髄核の再生治療方法を開発
- これまで椎間板髄核変性を治すことは困難だったが、iPS細胞から軟骨様髄核組織を作って移植することで可能に
- 日本では、約1300万人が腰痛を患い、その20〜40%は椎間板変性が原因となっている。椎間板変性は、多くの場合において髄核の変性・消失から始まると考えられている。
- 椎間板変性に伴う腰痛疾患の治療への応用に期待
本研究成果が社会に与える影響(本研究成果の意義)
日本では約1300万人が腰痛を患い、その20〜40%は椎間板変性が腰痛の原因と考えられています。椎間板変性は、多くの場合において髄核の変性・消失から始まると考えられています。
本研究成果により、変性・消失した髄核部分にhiPS-Cartを移植することで椎間板変性を防ぎ、腰痛を根治的に治癒する再生治療方法を開発することが期待されます。
研究者のコメント
髄核と軟骨の発生の研究成果を元に、2007年に開発されたiPS細胞とここ数年のシングルセルRNAシーケンス技術の進展を応用することで、髄核の中の軟骨様髄核組織の正体を詳しく調べ、試験管の中にその組織を作ることが出来ました。これを移植することで動物モデルにおいて椎間板変性を防ぐことを示せ、腰痛治療などへの臨床応用に向けて次のステップに進みたいと考えています。(妻木範行)
特記事項
本研究成果は、2022年3月30日(水)に米国科学誌「Biomaterials」(オンライン)に掲載されました。
なお、本研究は、AMED再生医療実現拠点ネットワークプログラム研究および科学研究費助成事業研究の一環として行われました。
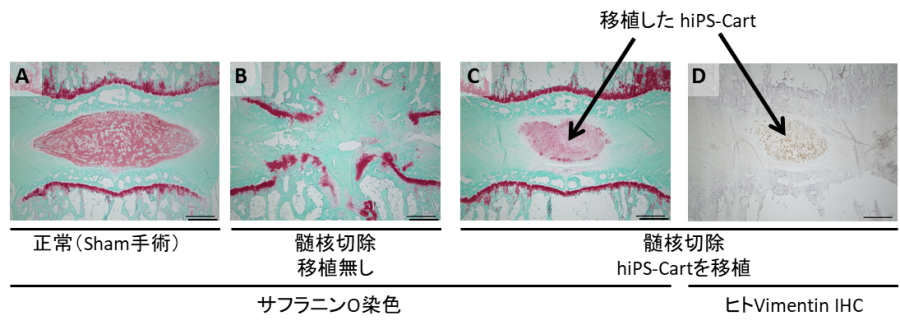
図1.ラット椎間板変性モデルにヒトiPS細胞由来髄核様組織(hiPS-Cart)を移植後6ヶ月の 組織像
A)正常(Sham手術群)の椎間板。髄核とその上下の帯状の成長軟骨板が赤く染まっている。B)髄核切除群。髄核は消失し、椎間板は変性・破壊され、上下の成長軟骨板が破綻している。C)髄核切除後にhiPS髄核を移植した群。椎間板の構造は保たれ、帯状の成長軟骨板も保たれている。D)C)の連続切片を、ヒトVimentinを特異的に認識する抗体で免疫染色したもの。ヒト細胞の存在が示されている、即ちhiPS髄核は生存し、生着していることがわかる。
用語解説
- 椎間板
脊椎(いわゆる「せぼね」)は椎体(骨)と椎間板が交互に積み重なる構造を持つ。椎間板は軸方向の荷重を緩衝するクッションの役割を果たすとともに、脊柱に可動性を与えている。 - 髄核
椎間板は、中心部の髄核とそれを取り囲む線維輪で構成される。髄核は髄核細胞と髄核細胞が作る細胞外マトリックスからなる。髄核の細胞外マトリックスの粘弾性・流体特性が、脊椎にクッション性と多方向への可動性をもたらす。また、細胞外マトリックスは、髄核細胞に適切な環境を提供することにより髄核細胞の分化に貢献している。 - 軟骨様髄核組織
髄核は形態的に軟骨に似た軟骨様髄核細胞と脊索に似た脊索様髄核細胞で構成される。発生過程において髄核細胞は脊索に由来し、軟骨様髄核細胞は脊索様髄核細胞が分化したものとされている。10才頃までに脊索様髄核細胞は消失し、以降、髄核は軟骨様髄核細胞のみで構成される。
| 原著論文 | Biomaterials 284:121491 (2022) |
|---|---|
| 論文タイトル | Human iPS cell-derived cartilaginous tissue spatially and functionally replaces nucleus pulposus |
| 著者 | Takashi Kamatani (1, 2), Hiroki Hagizawa (1, 2, 7), Seido Yarimitsu (3), Miho Morioka (1, 7), Saeko Koyamatsu (1, 7), Michihiko Sugimoto (4), Joe Kodama (2), Junko Yamane (5), Hiroyuki Ishiguro (2), Shigeyuki Shichino (6), Kuniya Abe (4), Wataru Fujibuchi (5), Hiromichi Fujie (3), Takashi Kaito (2), Noriyuki Tsumaki (1, 7)
|
| PubMed | 35395453 |
