染色体の凝集を担うタンパク質の新たな機能
早期老化症など希少疾患やがんに対する治療法に期待
| 原著論文 | EMBO Rep. e53581 (2022) |
|---|---|
| 論文タイトル | HP1 maintains protein stability of H3K9 methyltransferases and demethylases |
| 研究室サイト | エピゲノムダイナミクス研究室〈立花 誠 教授〉 |
概要
大阪大学大学院生命機能研究科の前田亮特任助教(常勤)と立花誠教授の研究グループは、HP1とよばれるタンパク質がヒストンH3の9番目リジンのメチル化(H3K9メチル化)形成に関わる酵素の安定化に必要であることを世界で初めて明らかにしました。早期老化症などの希少疾患やさまざまながんでH3K9メチル化の異常が観察されることから、H3K9メチル化の形成機構の解明はこれらの疾患に対する治療の足がかりになります。
HP1は、H3K9メチル化に結合するタンパク質として同定されました。ほ乳類には三種類のHP1タンパク質が存在します。これまで、三種類のHP1全てを欠損させてその機能を解析した研究はありませんでした。研究グループは、ゲノム編集技術を用いて三種類のHP1全てを欠損させた細胞を樹立し、正常な細胞と比較しました。その結果、HP1を欠損させた細胞では、H3K9メチル化酵素・脱メチル化酵素が著しく分解され、染色体が正しい構造をとれなくなることが分かりました。機能を一部欠損させたHP1変異体による解析から、HP1は、H3K9メチル化酵素や脱メチル化酵素を染色体に繋ぎ止め、これら酵素のタンパク質分解を防ぐことが分かりました(図1)。これらの研究結果は、これまで知られていたHP1の機能とは大きく異なるものでした。本研究成果をもとにしてHP1とH3K9メチル化酵素・脱メチル化酵素の結合を促進あるいは阻害する薬剤を開発すれば、H3K9メチル化の異常で引き起こされる疾患に対する新たな治療法につながると期待されます。
研究の背景
真核生物の染色体は、ヒストンとよばれるタンパク質複合体にDNAが巻きついた構造をとっています。ヒストンにメチル化やアセチル化などの化学修飾が施されることで染色体の凝集や弛緩が誘導され、その結果、遺伝子の発現量が変化します。このようなDNA配列の変化をともなわない遺伝子発現制御をエピジェネティックな制御といいます。エピジェネティックな制御は発生や分化に不可欠であり、そのシステムの破綻はがんなどのさまざまな疾患を引き起こします。そのため、エピジェネティックな制御を担うタンパク質の機能解明は、この病気の発症機能の解明や創薬研究に繋がります。
ヒストンH3の9番目のリジンのメチル化(H3K9メチル化)は遺伝子発現が抑制された領域にみられる典型的なエピジェネティック修飾です。HP1はH3K9メチル化に結合するタンパク質として同定されました。真核生物ではH3K9メチル化とHP1が必ずセットで保存されていることから、HP1はH3K9メチル化による遺伝子の発現抑制に必須と考えられてきました。ほ乳類ではHP1は三種類の類似した遺伝子によってコードされています。これまで、HP1のいずれか二種類を欠損した細胞では、目立った表現型は観察されていませんでした。そこで立花教授らの研究グループは、HP1の正確な機能を知るために、三種類のHP1をすべて欠損させた細胞を樹立し、解析をおこなうことにしました。
本研究の成果
はじめに研究グループは、HP1はH3K9を入れるメチル化酵素と結合することに着目しました。HP1に結合できないH3K9メチル化酵素タンパク質は不安定だという先行研究から、HP1はH3K9メチル化酵素タンパク質の安定性の維持に関わるのではないかと仮説を立てました。マウスES細胞を用いて、ゲノム編集技術により三種類のHP1全てを欠損させたところ、H3K9メチル化酵素タンパク質が大幅に減少することが分かりました。HP1完全欠損細胞の核内を電子顕微鏡で見てみると、染色体の凝集領域と弛緩領域の区別がつかないことが分かりました(図2)。これらの結果から、HP1はH3K9メチル化酵素のタンパク質の量を維持し、正しい染色体構造を維持するために必須であることが分かりました。
つぎに、HP1がどのようにH3K9メチル化酵素を安定化するのかを調べるために、機能が一部欠損したHP1変異体を用いて生化学解析をおこないました。H3K9メチル化酵素には結合できるがH3K9メチル化に結合できないHP1変異体はH3K9メチル化酵素を安定化できませんでした。このことから、HP1がこれらの酵素を安定化するためには、HP1と酵素の結合だけでなく、HP1が染色体に結合することも必要だと分かりました。また、HP1はH3K9を除く働きをする酵素も同様に安定化することも見つけました。
以上の結果から、HP1は、H3K9メチル化酵素・脱メチル化酵素を染色体につなぎ安定化するハブの役割を持つことが分かりました。
研究成果のポイント
- 染色体の凝集を担うタンパク質HP1に、これまで知られてなかったH3K9メチル化(ヒストンH3の9番目リジンのメチル化)酵素・脱メチル化(ヒストンの脱メチル化)酵素のタンパク質を安定化する役割があることを発見
- 正しい染色体構造を維持するためにはHP1タンパク質が必須であることを解明
- 本研究成果をもとにしてH3K9メチル化酵素・脱メチル化酵素の量を制御する薬剤を開発することで、H3K9メチル化の異常がみられる疾患の新たな治療法へ期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、HP1とH3K9メチル化酵素・脱メチル化酵素の結合が、これらの酵素の安定化に必須であることが分かりました。がんなどのさまざまな疾患でH3K9メチル化の異常が観察されます。これらの酵素とHP1の結合領域に入り結合を阻害、あるいは促進する薬物を開発することで、H3K9メチル化の異常が原因で引き起こされる疾患に対する治療法を提案できると考えています。
研究者のコメント
今回、H3K9メチル化酵素のタンパク質制御といったHP1の新たな機能を見つけることができました。今後は、創薬など医療に向けた研究とともに、ほ乳類の発生過程でこの制御機構は働いているのかについて調べていきたいと思います。(前田亮)
特記事項
本研究成果は、2022年2月15日(火)20時(日本時間)に欧州科学誌「EMBO reports」(オンライン)に掲載されました。
なお、本研究は、日本学術振興会科学研究費補助金、日本学術振興会科学研究費助成事業新学術領域研究「性スペクトラム」(領域代表:立花誠)の一環としておこなわれました。
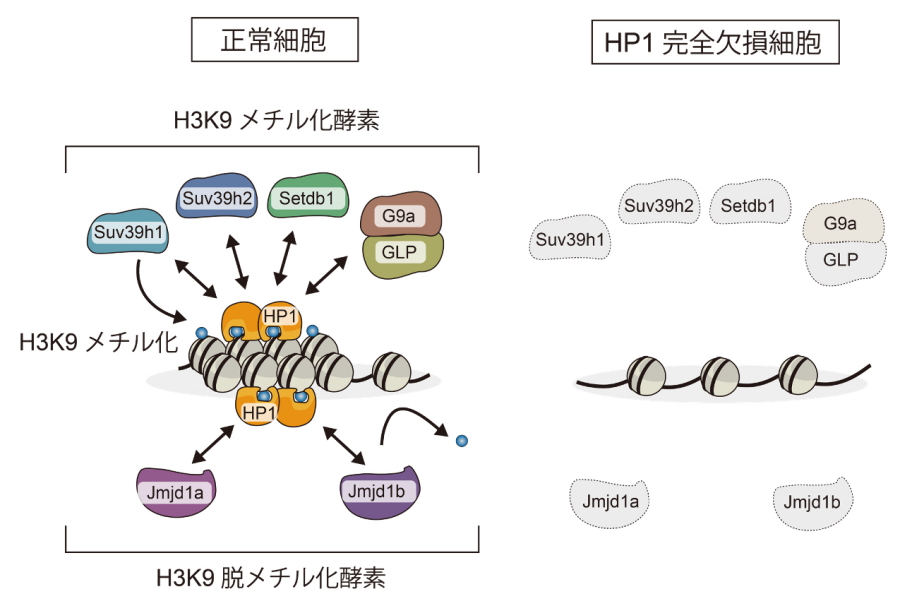
図1.本研究で明らかにしたHP1の機能
HP1はH3K9メチル化酵素・脱メチル化酵素と染色体上で複合体をつくることでこれらの酵素を安定化する(左)。HP1が欠損すると、これらの酵素は分解され、染色体構造の崩壊が引き起こされる(右)。
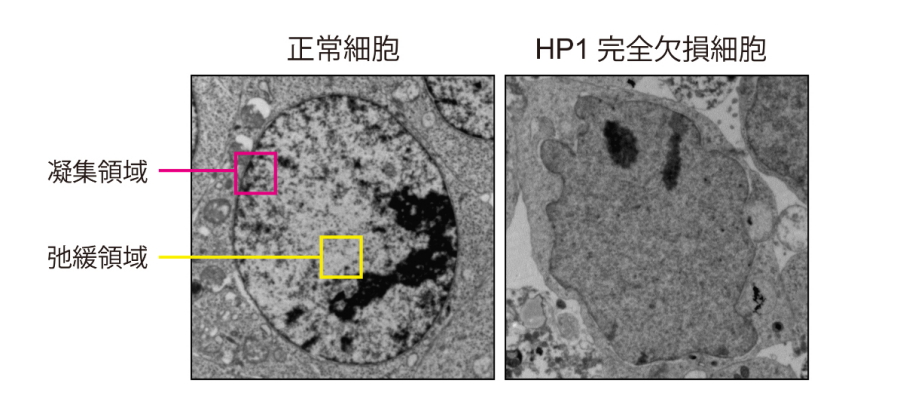
図2.電子顕微鏡による正常細胞とHP1完全欠損細胞の核の比較
正常細胞(左)の核では黒く染まった染色体の凝集領域(ピンク色部分)と、白く染まった弛緩領域(黄色部分)が明確に区別できる。一方で、HP1完全欠損細胞(右)の核は画像の濃淡が消失しており、染色体の凝集領域と弛緩領域の区別がつかない。
用語解説
- HP1
HP1(heterochromatin protein 1)は、H3K9メチル化に結合する核内タンパク質である。分裂酵母から哺乳類まで高度に保存されており、染色体の凝集や転写の抑制に関わることが知られている。 - H3K9メチル化(ヒストンH3の9番目リジンのメチル化)
真核生物のDNAはヒストンと呼ばれるタンパク質複合体に巻きついている。ヒストンの一つであるヒストンH3のN末端のアミノ酸はさまざまな化学修飾を受けることが知られている。なかでも9番目のリジンのメチル化は、染色体が凝集し、転写が抑制された領域にみられる代表的な修飾である。 - 脱メチル化(ヒストンの脱メチル化)
メチル化されたヒストンからメチル基を取る化学反応であり、脱メチル化酵素とよばれるタンパク質によりおこなわれる。メチル化酵素と脱メチル化酵素がはたらくことで、ヒストンのメチル化は動的かつ可逆的に制御される。 - ゲノム編集
CRISPR/Cas9などのシステムを用いて、任意のゲノム領域を切断したり、入れ替えたりする技術。このシステムを細胞に導入することで、一月ほどで目的のゲノムが改変された細胞を樹立できる。
| 原著論文 | EMBO Rep. e53581 (2022) |
|---|---|
| 論文タイトル | HP1 maintains protein stability of H3K9 methyltransferases and demethylases |
| 著者 | Ryo Maeda (1, 2), Makoto Tachibana (1, 2)
|
| PubMed | 35166421 |
