細菌の回転モーターの複雑な回転子構造を解明
1種類のタンパク質34分子が2つの異なる構造で回転子リングを形成
| 原著論文 | Nat. Commun. 12:4223 (2021) |
|---|---|
| 論文タイトル | Native flagellar MS ring is formed by 34 subunits with 23-fold and 11-fold subsymmetries |
| 研究室サイト | 日本電子YOKOGUSHI協働研究所〈難波 啓一 特任教授(常勤)〉 |
概要
大阪大学大学院生命機能研究科日本電子YOKOGUSHI協働研究所の研究スタッフ(川本晃大特任助教(現在は同大学蛋白質研究所助教)、宮田知子特任准教授(常勤)、牧野文信招へい准教授(日本電子(株))、木下実紀特任助教(常勤)、加藤貴之特任准教授(現在は同大学蛋白質研究所教授)、難波啓一特任教授)、そして同研究科プロトニックナノマシン研究グループの南野徹准教授、同大学大学院理学研究科の今田勝巳教授らの共同研究グループは、細菌べん毛の根元で回転モーターとして機能するべん毛基部体のうち、回転子として機能するMSリングの構造をクライオ電子顕微鏡により明らかにしました。
細菌はべん毛と呼ばれる運動器官を持ち、細胞外に長く伸びたらせん型のべん毛繊維をプロペラとし、その根元にある人工回転モーターとよく似たべん毛モーターで回転させて遊泳します。べん毛は、回転モーターとして働く基部体、ユニバーサルジョイントのフック、らせん型プロペラである繊維の3つの部分構造で構成されており、30種類ほどのタンパク質が段階的に集合して自律的に組み上がることで構築されます(図1)。細菌べん毛は、まず膜タンパク質FliFがモーターの回転子にあたるMSリングを細胞膜中に形成し、それを土台にして他の構成タンパク質が順序よく集合して組み上がって行きます。べん毛モーターは、細胞膜内外の電位差と水素イオン濃度差により水素イオンが細胞内に流れ込むエネルギーを動力源としてトルクを発生し、その回転を細胞外に伸びるべん毛繊維に伝えますが、回転子リングはその中心的役割も担っています。共同研究グループはクライオ電子顕微鏡による単粒子構造解析法を用いてこの回転子リングの全体構造を明らかにし、べん毛繊維を含むべん毛全体がスムーズに構築されていく仕組みや、発生したトルクをプロペラにしっかりと伝える仕組みを明らかにしました。
研究の背景
サルモネラや大腸菌等の細菌は、菌体の周囲にべん毛と呼ばれる長いらせん繊維状の運動器官を数本持ち、それらを回転させることで推進力を発生し、最適な環境を求めて自由に泳ぎ回ることができます。その回転を駆動するモーターは巨大な膜タンパク質複合体であるため構造解析が難しく、べん毛の構築開始やトルク発生のメカニズムはずっと不明のままでした。回転子リングは膜タンパク質FliFが細胞膜内に自律集合して形成されますが、結晶化が困難であるためX線結晶構造解析が適用できず、その構造も長らく解析できないままでした。
本研究の成果
共同研究グループは、最近目覚ましい進歩を遂げたクライオ電子顕微鏡による単粒子構造解析法を用いることで、回転子リングおよびそれを含む基部体の立体構造を解析しました(図2)。そしてこの構造から、1)34分子のFliFタンパク質が2つの異なる構造で集合して回転子リングを形成していること、2)その結果、回転子リングの内部に34回、23回、11回の回転対称構造があることを発見しました(図3)。
実はこの研究成果の発表直前に同様の回転子リング構造が英国の研究グループにより発表されましたが、その構造では回転対称性、つまり構成分子FliFの数が34分子と一定ではなく、33分子から35分子まで複数種類のリング構造が観察されていました。しかし、この構造解析に使われた試料が大腸菌による大量発現系から精製されたFliFが形成したリングで、しかもこのFliF試料ではC末端が様々な長さで欠損していたことから、回転子リングの構造バリエーションはFliFのC末端欠損によることが疑われました。そこで本共同研究グループは、試料とした大量発現系FliFがC末端欠損のない全長分子であることを確認、またサルモネラ菌から単離精製したべん毛基部体の構造解析も行いました。それにより両方の構造で回転子リングが34分子で構成されていることが確認され、その高分解能構造が明らかとなり、分子モデルが構築できました。
また、英国のグループによって解析されたリング構造の対称性バリエーションがFliFのC末端欠損によることを確実に証明するため、C末端から57アミノ酸残基と104アミノ酸残基を欠損した2種類のFliFフラグメントを大量発現させて回転子リングを精製し、クライオ電子顕微鏡による単粒子像解析法で構造を解析しました。その結果、57アミノ酸残基を欠損したFliFでは33分子が、104アミノ酸残基を欠損したFliFでは34分子および35分子がリングを形成していることを明らかにしました。
これらの結果は、生体分子複合体の構造から機能発現のメカニズムを解明する際、大量発現系から再構成した複合体であれば全長の構成タンパク質が形成する複合体の構造を見ることの大切さ、そして、できれば細胞内で機能する複合体そのものの構造を観察することの大切さを示すものです。
研究成果のポイント
- 細菌べん毛モーターの回転子リングの構造をクライオ電子顕微鏡により決定
- 34分子のFliFタンパク質が2つの異なる構造で集合して回転子リングを形成していることを解明
- その結果、回転子リングの内部に34回、23回、11回の回転対称構造があることも判明
- エネルギー変換効率が100%に近い人工ナノマシンの開発への貢献に期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は、細菌べん毛の自律的形成メカニズムやべん毛モーターのトルク伝達機構において重要な役割を担う膜貫通複合体としての回転子リングの機能構造を初めて明らかにしたもので、エネルギー変換効率の高い人工ナノマシンの開発などへの貢献が期待されます。また、これまで極めて困難であった巨大な膜タンパク質複合体の構造解析が可能になったのはクライオ電子顕微鏡法の目覚ましい進歩によるものです。特にC末端欠損FliFリングの構造解析は論文審査委員の意見に対応するために急遽実施したもので、タンパク質の発現系構築からわずか2週間ほどで複数のリング構造の高分解能構造解析を完了しましたが、これは日本電子社製の最先端クライオ電子顕微鏡CRYO ARM 300に関する独自の技術開発によるものです。CRYO ARM 300が冷陰極型の電界放射型電子銃を装備したことによる解像度の大幅な改善と、電子線制御技術の工夫によって自動撮影速度が2020年当初の約20倍の一日22,000枚へと格段の高速化を達成したことで、迅速な構造解析が可能になりました。このことはクライオ電子顕微鏡法の創薬応用に向けた極めて高いポテンシャルを示しており、ナノ工学や医療創薬の今後の発展に大きく貢献すると期待されます。
特記事項
本研究成果は「Nature Communications」のオンライン版で2021年7月9日(金)午後6時(日本時間)に公開されました。
なお、本研究は、日本学術振興会科学研究費補助金JP25000013(研究代表者:難波啓一)、JP18K06155、JP20770083(研究代表者:宮田知子)、JP18K14639(研究代表者:川本晃大)、JP19H03182、JP26293097(研究代表者:南野徹)、JP15H05593、JP20K15749(研究代表者:木下実紀)、JP15H02386(研究代表者:今田勝巳)、文部科学省科学研究費補助金JP15H01640、JP20H05532(研究代表者:南野徹)、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技支援基盤プラットフォーム(BINDS)課題番号JP19am0101117、および医療研究開発革新基盤創成事業(CiCLE)課題番号JP17pc010102(研究代表者:難波啓一)の助成を受けたものです。
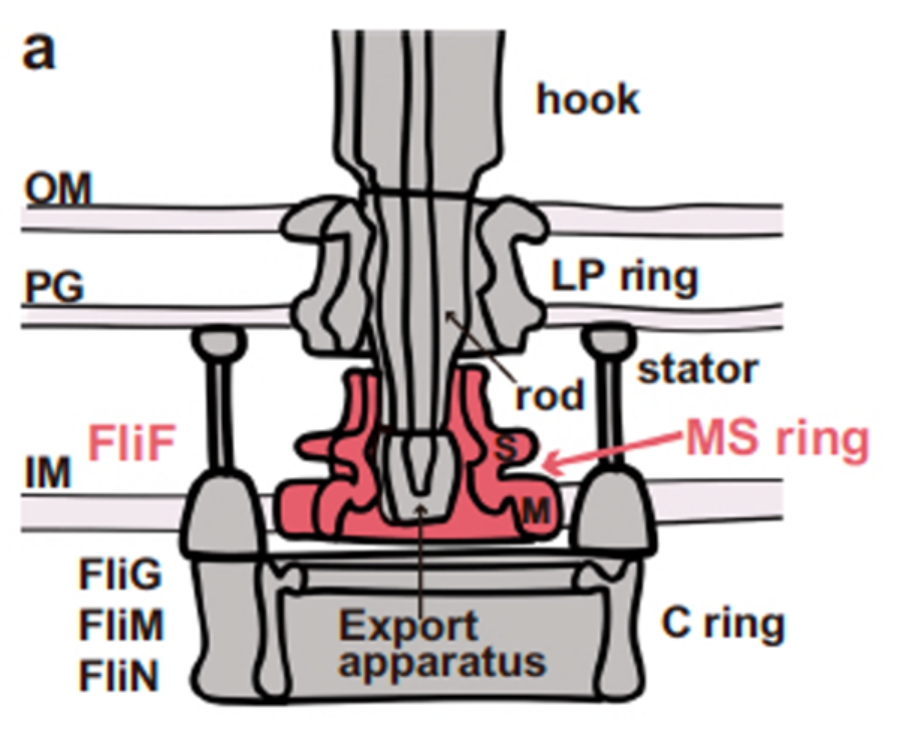
図1.細菌べん毛基部体の構造模式図
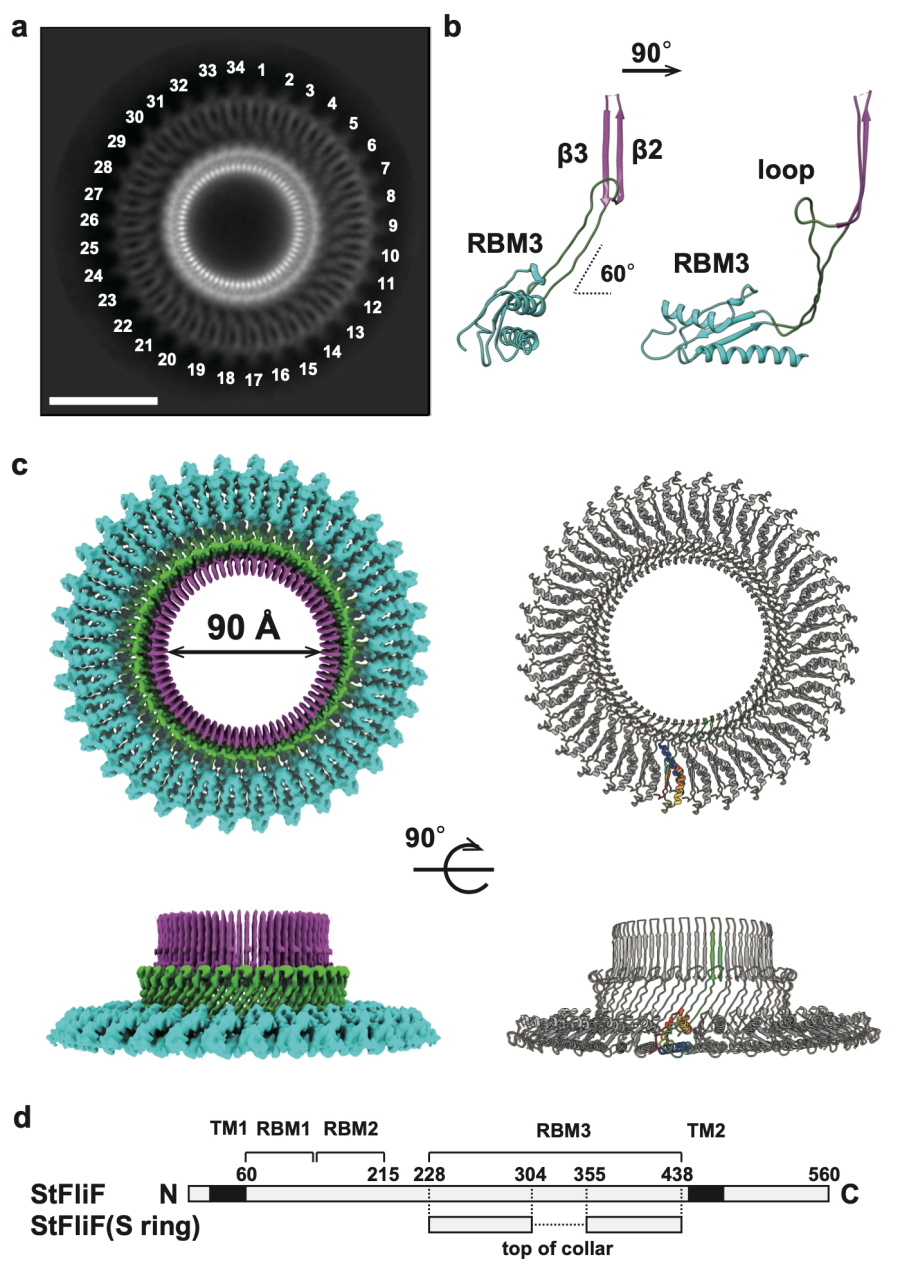
図2.全長FliFが形成するSリングの立体構造
A)34分子のFliFからなるSリングのクライオ電子顕微鏡による軸投影像。b)リング中のFliF分子の構造を示す主鎖のリボンモデル。c)FliFリングのクライオ電子顕微鏡による密度マップ(左)と主鎖の構造モデル(右)。上は軸方向、下は側方から。d)FliFの全長アミノ酸配列でSリングに相当する領域を示す。
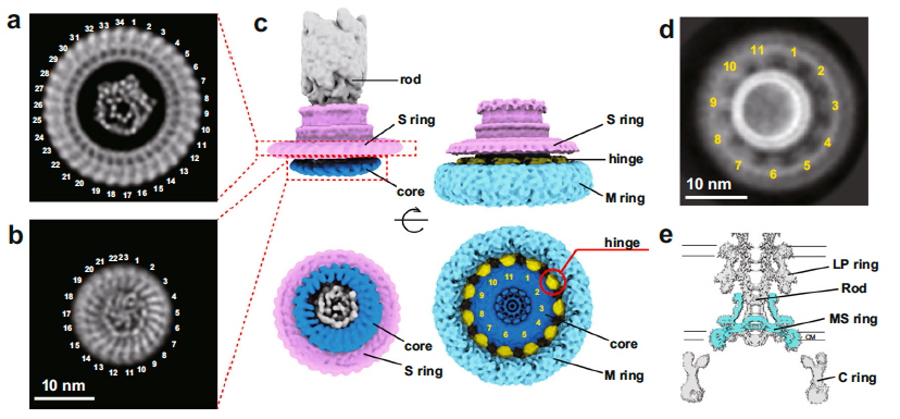
図3.べん毛基部体中のMSリングの立体構造
A)34分子のFliFからなる基部体Sリングの構造。b)23分子のFliFからなるMリングのコア構造。中心部に見えるのはべん毛タンパク質輸送装置のゲート複合体。c)基部体(左)と大量発現した全長FliFが形成するMSリング(右)の構造。上側は側方から、下側は細胞内から見た像。d)FliFリングの投影像に見える11回回転対称構造。e)基部体中でMSリングの占める領域(空色)。
用語解説
- クライオ電子顕微鏡
電子顕微鏡用グリッド上で急速凍結しアモルファスな氷薄膜に包埋したタンパク質や細胞など生体試料を極低温で保持して観察できる透過型電子顕微鏡。 - ユニバーサルジョイント
モーターの回転などを様々に異なる方向へ伝達する装置で自在継ぎ手とも呼ばれる。 - 単粒子構造解析法
透過型電子顕微鏡により様々な方向で撮影された数多くの生体分子像から立体像を再構成する画像解析法。クライオ電子顕微鏡により撮影された数千枚の電子顕微鏡像から得られた数十万の分子像を解析することにより2Åを超える高分解能の構造解析が可能。試料はわずか数マイクロリットルの水溶液で良いのが大きな特徴。 - X線結晶構造解析
結晶にX線を照射して得られた回折像の反射強度分布から結晶内の原子の立体配置を求める方法で、タンパク質など生体分子の構造解析にも使われるが、時間と労力のかかる結晶化条件の探索により良質な結晶を得ることが必須。 - 回転対称構造
複数の分子が形成するリング状やディスク状の構造で、分子数に応じた回転対称性を持つ構造。 - 大腸菌による大量発現系
標的タンパク質の遺伝子を大腸菌に挿入して大量に発現させるシステムで、構造解析や生化学的解析に頻繁に使われる。 - C末端
タンパク質は多数のアミノ酸からなる一本鎖のポリペプチドで、最初にアミノ基があるためN末端と呼ばれ、最後にカルボキシル基があるためC末端と呼ばれる。 - 冷陰極型の電界放射型電子銃
電子顕微鏡の電子銃のうち電界で電子を引き出すタイプのものを電界放射型電子銃と呼び、なかでも電子銃のチップを高温にして安定な電子線を発するのがショットキー型、超高真空にすることにより室温で干渉性の高い電子線を引き出すのが冷陰極型と呼ばれる。
| 原著論文 | Nat. Commun. 12:4223 (2021) |
|---|---|
| 論文タイトル | Native flagellar MS ring is formed by 34 subunits with 23-fold and 11-fold subsymmetries |
| 著者 | Akihiro Kawamoto (1, 2), Tomoko Miyata (1), Fumiaki Makino (1, 3), Miki Kinoshita (1), Tohru Minamino (1), Katsumi Imada (4), Takayuki Kato (1, 2), Keiichi Namba (1, 5, 6)
|
| PubMed | 34244518 |
