霊長類細胞は二刀流で熱ストレスに対処する
RNA構造体による遺伝子発現制御機構の発見
| 原著論文 | EMBO J. e107976 (2021) |
|---|---|
| 論文タイトル | m6A-modification of HSATIII lncRNAs regulates temperature-dependent splicing |
| 研究室サイト | RNA生体機能研究室〈廣瀬 哲郎 教授〉 |
概要
大阪大学大学院生命機能研究科の二宮賢介特任講師(常勤)、廣瀬哲郎教授(大学院理学研究科兼任)らの研究グループは、細胞が高温(熱ストレス)に晒されたときに核内で作られる構造体「核内ストレス体」が、高温ストレスから回復する過程で2つの異なるメカニズムを併用して遺伝子発現を調節していることを明らかにしました。
核内ストレス体は、霊長類の細胞に特有の構造体で、熱ストレスによって転写されるHSATIIIノンコーディングRNA(lncRNA)を足場にして作られます。これまでに、本研究グループは、核内ストレス体が制御タンパク質のリン酸化反応の「るつぼ(reaction crucible)」として働き、RNAスプライシングを制御していることを明らかにしてきましたが、この核内ストレス体がさらなる新たな制御機能を持っていることが示唆されていました。
今回、本研究グループは、HSATIIIが核内でRNAのメチル化修飾を受けること、これに伴って、核内ストレス体が周囲からメチル化関連タンパク質を吸い込んで閉じ込めてしまう「スポンジ(molecular sponge) 」として働き、それによって周囲のmRNAのメチル化修飾を抑えていることを発見しました。その結果、RNAのメチル化修飾によって起こるスプライシングが抑制されていることも分かりました。さらに、前述の「るつぼ」と今回明らかとなった「スポンジ」は、HSATIIIのRNA配列の大半を占めるGGAAUという5塩基の反復配列が足場となり、そのメチル化の有無によってそれぞれ異なるタンパク質を集めてくることで、異なる機能を発現することが明らかになりました(図1、2)。以上により、核内ストレス体は、共通のlncRNA骨格による「スポンジ」と「るつぼ」という2つの機構を通した温度依存的なRNAスプライシング制御を行う多機能構造体であることが明らかになりました。今後、霊長類特有の熱ストレス応答機構の解明や霊長類への進化の謎に迫ることが期待できます。
研究の背景
これまで、細胞といえば膜に囲まれた細胞内小器官で満たされているイメージが先行していましたが、細胞内には様々な膜構造を持たない非膜性構造体が存在しています。これらは特定のタンパク質や核酸を内部に集積することによって「るつぼ」「スポンジ」などの様々な調節機能を果たしていると考えられてきました。「核内ストレス体」は熱ストレスによって作られる非膜性構造体で、霊長類にだけ存在します。しかし、その発見から30年経つ現在でも、その機能や役割、なぜ霊長類の細胞にしか存在しないのかについては、謎に包まれたままでした。最近、本研究グループは、熱ストレスによって形成された核内ストレス体が、正常な温度に戻ってからのストレス回復期に400種以上の遺伝子のスプライシングを制御することを明らかにしました。また、その作動機構として、核内ストレス体がRNAスプライシング因子とそのリン酸化酵素を濃縮し、リン酸化反応を促進する「るつぼ」として働くことを明らかにしました。
本研究の成果
今回、本研究グループでは、核内ストレス体の構成成分やその修飾の状態を温度変化と時間経過に沿って詳細に解析することによって、HSATIII lncRNAのメチル化修飾を介して「スポンジ」として働くことを明らかにし、それによってメチル化に依存した周囲のmRNAのスプライシングを抑制していることを解明しました。
研究成果のポイント
- 核内ストレス体形成の足場となるHSATIIIノンコーディングRNA(lncRNA)が温度変化に応答してRNAメチル化修飾を受けることを発見。
- 核内ストレス体は、周囲に存在するメチル化関連タンパク質を閉じ込める「スポンジ」として働き、他のmRNAのメチル化修飾を抑制し、その結果RNAスプライシングを抑制していた。
- HSATIIIの大半を占める単純な反復配列が、部分的にメチル化されることによって「スポンジ」と「るつぼ」という2つのスプライシング制御機構を両立させていた。
- 以上から、「核内ストレス体」が、高温ストレスから回復する過程で2つの異なるメカニズムを併用して遺伝子発現を調節していることが明らかになり、霊長類が熱ストレス応答機能を獲得した理由や疾患発症機構の解明への寄与に期待。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は、長年謎に包まれていた霊長類特有の核内構造体である核内ストレス体の分子機能を明らかにしました。今後、本成果を足掛かりに、核内ストレス体の生理的意義を明らかにすることで、「霊長類特有の熱ストレス応答機構」や「進化過程での制御機能の獲得意義」という根源的な謎に迫ることが期待できます。また、RNAのメチル化修飾は、近年、エピトランスクリプトーム研究として大きな注目を浴びている哺乳類細胞で最も主要なRNA修飾であり、RNAのプロセシングや核外輸送・翻訳などを制御して、生体内の様々な生理機能やがんをはじめとした疾患の発症機構に関わっています。本研究成果は、熱ストレス応答とRNAメチル化修飾を機能的に結び付けるものであり、メチル化修飾が関わる概日リズムなどの様々な生理現象やがんをはじめとした疾患の発症機構の解明にも寄与することが期待できます。さらに、単純な反復配列を持つリピートRNAが修飾によって複数の機能を獲得できることを示す先駆的な例として、リピートRNAの生理的な機能や、配列の異常伸展によって発症する神経疾患の発症機構の解明にもつながることが期待されます。
研究者のコメント
今世紀初め、ヒトゲノムが産生している大量のlncRNAが発見されて以来、その存在意義の理解は生物学の大きな課題でした。今回の研究で、lncRNAのメチル化修飾を通して、1つのlncRNAが「スポンジ」と「るつぼ」という2つの特有な機能を獲得しているという新たな機能獲得戦略を見いだしました。こうしたlncRNAの基礎的知見が、類似のリピートRNAに起因した難病の発症機構の理解につながることが期待されます。(廣瀬哲郎)
特記事項
本研究成果は、2021年6月29日(火)午後7時(日本時間)に欧州科学誌「The EMBO Journal」(オンライン)に掲載されました。
なお、本研究は、JST戦略的創造研究推進事業CREST(JPMJCR20E6)、JST戦略的創造研究推進事業ERATO(JPMJER2002)、日本学術振興会 科学研究費補助金、日本学術振興会 科学研究費助成事業 新学術領域研究「非ゲノム情報複製」「RNAタクソノミ」「先進ゲノム支援」の一環として行われました。
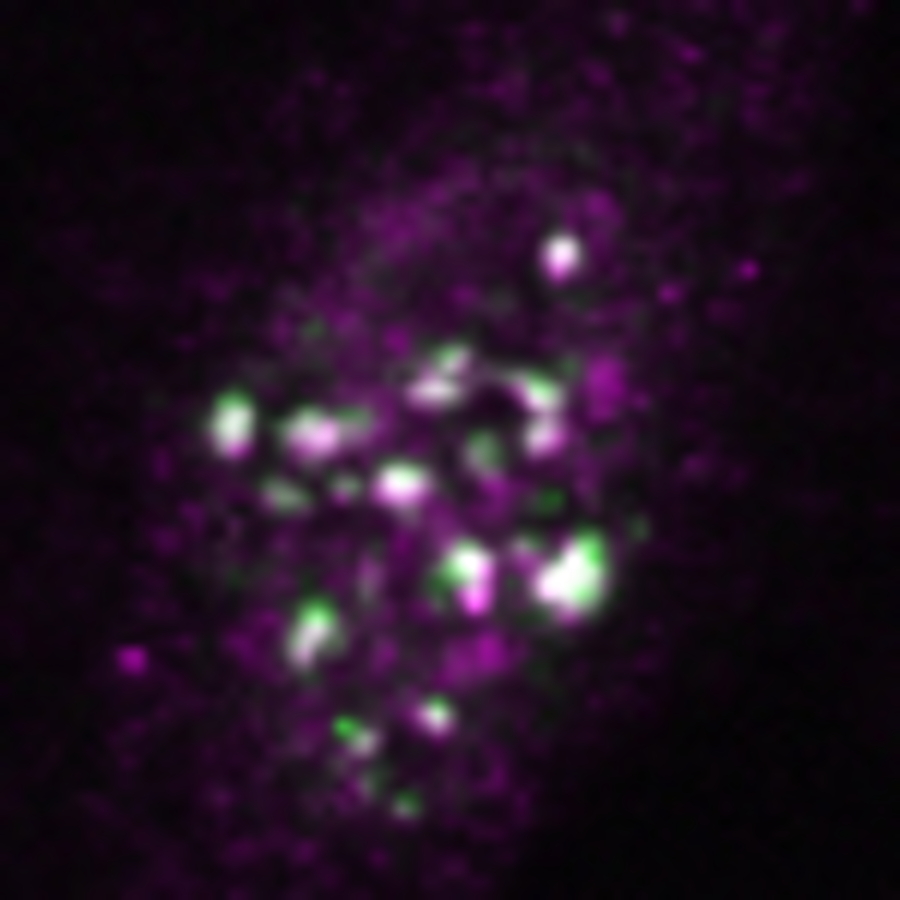
図1.核内ストレス体の蛍光顕微鏡イメージ
HSATIII(緑)とメチル化関連因子(マゼンタ)が共局在して白く見えている顆粒状構造体が核内ストレス体。
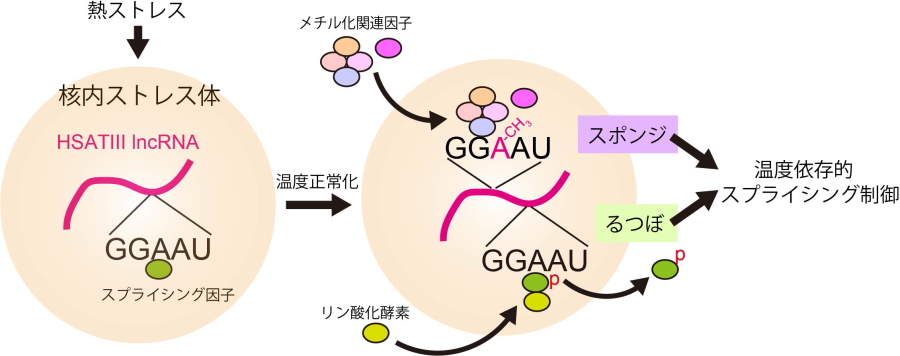
図2.核内ストレス体の機能モデル
熱ストレスに応答してHSATIII lncRNAを骨格に形成された核内ストレス体は、温度正常化に伴って「スポンジ」「るつぼ」としての働きを通して温度依存的スプライシングを制御している。
用語解説
- 核内ストレス体
熱ストレスによって形成される霊長類細胞特有の核内構造体で、後述のHSATIIIノンコーディングRNAを骨格として形成される。HSATIII上に100種類以上のタンパク質が集積することによって形成され、温度が正常化した後のストレス回復期に遺伝子発現制御を行う。 - HSATIIIノンコーディングRNA(lncRNA)
霊長類細胞の複数の染色体のセントロメア近傍に存在するサテライトIII領域から、熱ストレス時に転写されるタンパク質をコードしないRNA(ノンコーディングRNA、lncRNA)。RNA配列の大半をGGAAUの反復配列が占めている。 - RNAメチル化修飾
RNAの特異的なヌクレオチドにメチル基が付加される化学修飾。RNAの機能やタンパク質との複合体形成に多様性をもたらす。メチル化修飾には様々な種類があるが、HSATIII lncRNAの場合は、m6A修飾というもので、アデニン塩基(A)にメチル基が付加されるものである。m6A修飾は、哺乳類細胞で最も多く見られるRNAメチル化修飾でRNAプロセシング、RNA安定性制御、翻訳制御などに関わっている。メチル化修飾を行う酵素複合体、修飾部位に結合して他の因子との結合を仲介するタンパク質、修飾を除去する酵素などを総称してメチル化関連タンパク質と呼ぶ。 - スポンジ(molecular sponge)
分子スポンジともいう。細胞内構造体の機能モデルの1つ。特定のタンパク質や核酸を構造体内に大量に取り込み、周囲の細胞内領域での濃度を低下させることで、それらの因子の本来の機能を阻害する。 - RNAスプライシング
真核生物の遺伝子配列の大半は、エキソンとイントロンの領域に分かれ遺伝情報が分断されている。遺伝子発現の過程で、転写された前駆体mRNAからスプライシング反応によってイントロンが除去され、エキソン同士が連結することで、成熟型mRNAが産生される。個々のRNAのスプライシングは、スプライシング因子のリン酸化やmRNAのメチル化修飾などによって複雑に制御されている。 - るつぼ(reaction crucible)
細胞内構造体の機能モデルの1つ。特定のタンパク質や核酸を構造体内に取り込み濃縮することで、分子間の相互作用や酵素反応を促進・増強させる。 - エピトランスクリプトーム研究
遺伝子の転写産物(トランスクリプト)であるRNAは、転写後に約160種類にも及ぶ化学修飾を受けることで、その後のプロセシングや安定性、翻訳などについて様々な制御を受ける。遺伝子の転写産物の総体(トランスクリプトーム)の解析に対して、転写後のRNA修飾の包括的な解析をエピトランスクリプトーム研究と呼ぶ。
| 原著論文 | EMBO J. e107976 (2021) |
|---|---|
| 論文タイトル | m6A-modification of HSATIII lncRNAs regulates temperature-dependent splicing |
| 著者 | Kensuke Ninomiya (1, 2), Junichi Iwakiri (3), Mahmoud Khamis Aly (2, 4), Yuriko Sakaguchi (5), Shungo Adachi (6), Tohru Natsume (6), Goro Terai (3), Kiyoshi Asai (3), Tsutomu Suzuki (5), Tetsuro Hirose (1, 2)
|
| PubMed | 34184765 |
