細胞分裂に働く因子の新知見。鍵を握るヒト特有のアミノ酸
新たな観点での抗がん剤開発に期待
| 原著論文 | Cell Reports (2020) |
|---|---|
| 論文タイトル | Essentiality of CENP-A depends on its binding mode to HJURP |
| 研究室サイト | 染色体生物学研究室〈深川 竜郎 教授〉 |
概要
大阪大学大学院生命機能研究科の堀哲也准教授・深川竜郎教授らの研究グループは、細胞分裂の際に、遺伝情報の伝達に重要な染色体分配の鍵を握るタンパク質、CENP-Aの配列に関して、これまでの議論に終止符を打つ発見をしました。
今回、本研究グループは、ニワトリ細胞を用いた網羅的な変異体解析を行い、これまでヒト細胞では重要ではないと思われていたアミノ酸配列が、実は重要であることを明らかにしました(図1)。これは、CENP-Aとその結合タンパク質との相互作用の鍵となるアミノ酸配列が、細胞や生物種ごとに異なることを示しています。本成果から、染色体分配の異常で発症する「がん」において、細胞ごとに効果が違うことを利用した薬剤開発への応用が期待されます。
研究の背景
人を含む全ての動植物は複数の細胞からなる多細胞生物です。細胞は細胞分裂により増殖、成長して個体を形成します。その細胞分裂において、細胞が持つ遺伝情報を正確に次世代の細胞へ伝えることは生物の生存に欠かせない大事な過程です。この過程は、遺伝情報が書き込まれたDNAを含む染色体が正しく次世代の細胞に振り分けられる「染色体分配」により行われます。染色体分配の異常が生じ、遺伝情報が正しく次世代細胞に伝わらなければ、細胞は死滅するか、場合によっては「がん」や染色体数の異常による疾患を引き起こします。
染色体上に形成される動原体と呼ばれる構造が染色体を引っ張る糸、微小管との結合を橋渡しして、染色体分配が行われることが分かっています。この動原体は、染色体上のセントロメアと呼ばれるごく限られた領域にのみ形成されます。動原体が形成される位置を決める仕組みは、染色体分配を正確に行う上で重要な過程と考えられ、その制御の仕組みの解明が大きな課題でした。これまでの研究から、脊椎動物では、染色体上にCENP-Aというタンパク質の目印を付けることで、動原体の形成される位置が決められることが知られています(図2)。その目印を入れる過程において、CENP-Aは補助タンパク質、HJURPとの結合が必要と理解されています。
一方で、CENP-A自体の機能発現のために重要なアミノ酸については、多くの研究者でデータが異なり、議論がありました。CENP-Aは抗がん剤のターゲットとしても考えられているので、CENP-Aの機能の核心を明らかにすることは極めて重要でした。
本研究の成果
今回、本研究グループは、3つの発見をしました。
まず、ニワトリ由来の細胞を利用してCENP-Aタンパク質を対象とした網羅的な変異体解析を行った結果、CENP-Aの59番目のアラニン(A59)が、染色体分配に必須なアミノ酸であることを発見しました(図3)。このCENP-Aのアミノ酸A59に変異を入れると、CENP-Aが目印として機能しなくなり、結果として動原体が形成されず、染色体分配が正常に起こらなくなりました(図1、4)。このニワトリCENP-AのA59に相当するアミノ酸は、ヒトを含む他の脊椎動物のCNEP-Aにも広く存在し、進化的にも重要なアミノ酸であることが強く示唆されました。
しかし、ヒト細胞では、CENP-AのA59に相当するアミノ酸に変異を入れても、動原体の形成に異常は観察されないという報告がある一方、重要性を示す報告もあり、議論が分かれていました。この生物種での違いの原因についてさらに解析を行いました。
その結果、2つ目の発見として、ヒトでは、CENP-Aと結合して機能を補助するHJURPタンパク質内に、ニワトリには無い特有なアミノ酸、アルギニン残基が存在し、CENP-Aとの結合を強めていることを発見しました。さらに、3つ目の発見として、マウスなどにはこのアルギニン残基がなく、ニワトリと同様にCENP-AのA59に相当するアミノ酸が、染色体分配に重要であることもわかりました。
これらの研究から、HJURP内のアルギニン残基の有無により上記の生物種での違いが生じる、と結論付けました。ヒトにおいてもこのアルギニン残基を変えることで、CENP-Aの機能をコントロールできると思われます。CENP-Aは抗がん剤の重要なターゲットですが、そのサポート因子HJURP側との相互作用の鍵となるアミノ酸配列の発見は、新たな観点での薬剤開発へとつながる結果です。
研究成果のポイント
- 細胞分裂に伴う染色体分配に関わるタンパク質の知見に関して、議論に終止符を打つ発見
- 染色体分配に重要なCENP-Aを構成するアミノ酸配列で、どの部位が機能に必須であるかを解明
- ニワトリとヒトではCENP-Aの機能に重要なアミノ酸が異なる
- CENP-Aと結合するタンパク質との相互作用の鍵となるアミノ酸配列が生物種で異なることを発見
- 細胞ごとに効果が異なる治療薬の開発応用に期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、染色体分配を制御する仕組みの一端が明らかになりました。本研究で得られた成果をもとに、分子レベルの理解が飛躍的に進むことで、染色体分配の異常で発症する「がん」や染色体疾患の治療に向けた創薬開発などの応用研究の促進が期待されます。
研究者のコメント
染色体分配は生命機能を維持する上で大事な生命現象です。この過程は動原体を構成する複数のタンパク質が協調して働くことで、より強固な仕組みになっていると考えられています。そのため、今回ニワトリ細胞で発見した、たった1箇所のアミノ酸変異で染色体分配に異常を生じる例は珍しいと言えます。ヒト細胞で上記のアミノ酸の機能を補完する働きを持つ特有なアミノ酸の追加が見られたのは、より強固な仕組みを獲得する進化の過程と言えるかもしれません。(堀哲也)
特記事項
本研究成果は、米国科学誌「Cell Reports」に、11月18日(水)午前1時(日本時間)に公開されました。
なお、本研究は、下記研究費の一環として行われ、東京大学・定量生命科学研究所の胡桃坂仁志教授の協力を得て行われました。
- 科学研究費補助金 基盤研究(S)「染色体分配に必須なセントロメアの形成機構の解明」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
- 科学研究費補助 新学術領域研究「非ゲノム情報によって制御されるセントロメアの維持・形成機構」(研究代表:深川竜郎(大阪大学大学院生命機能研究科教授))
- 科学研究費補助金 基盤研究(B)「ゲノム分配を保障するセントロメアクロマチン構造の構築・変換メカニズム」(研究代表:堀哲也(大阪大学大学院生命機能研究科准教授))
- 科学研究費補助金 基盤研究(C)「動原体構築に必須な細胞周期に依存したセントロメアクロマチン形成機構の解明」(研究代表:堀哲也(大阪大学大学院生命機能研究科准教授))
- 科学研究費補助金 新学術領域研究(先進ゲノム支援)
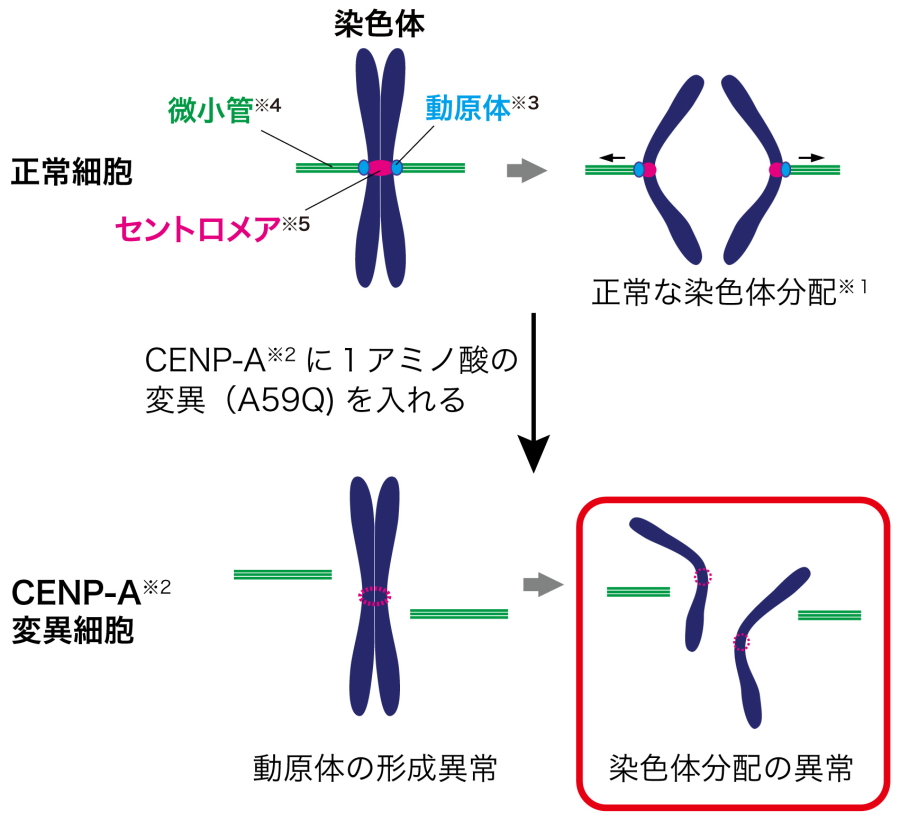
図1.染色体分配の鍵を握るアミノ酸
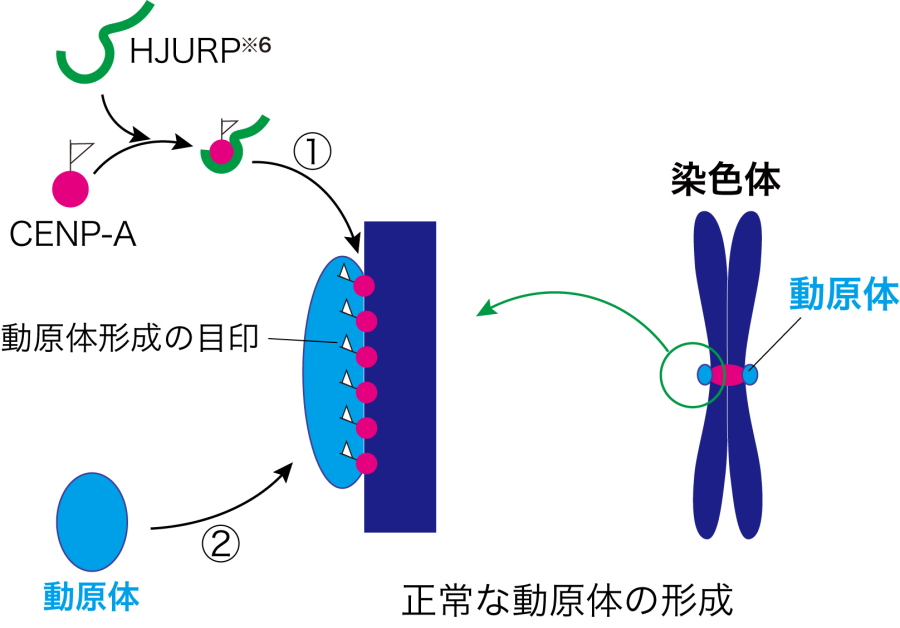
図2.動原体形成の目印
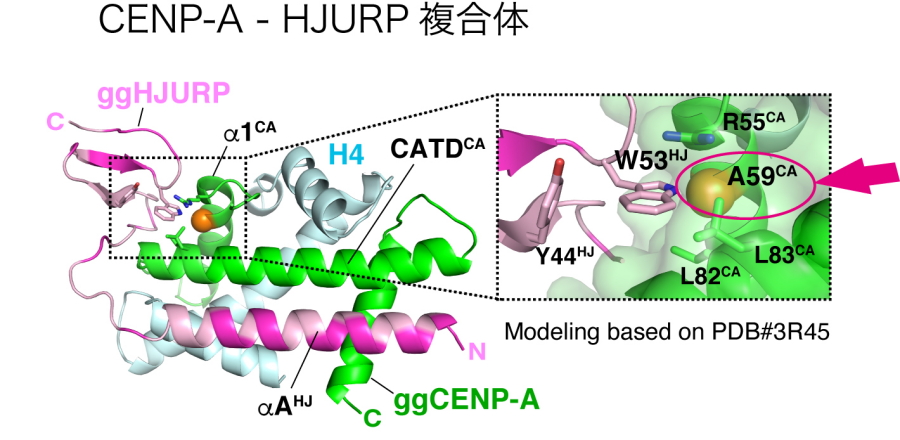
図3.染色体分配に必須なCENP-Aのアミノ酸(矢印)
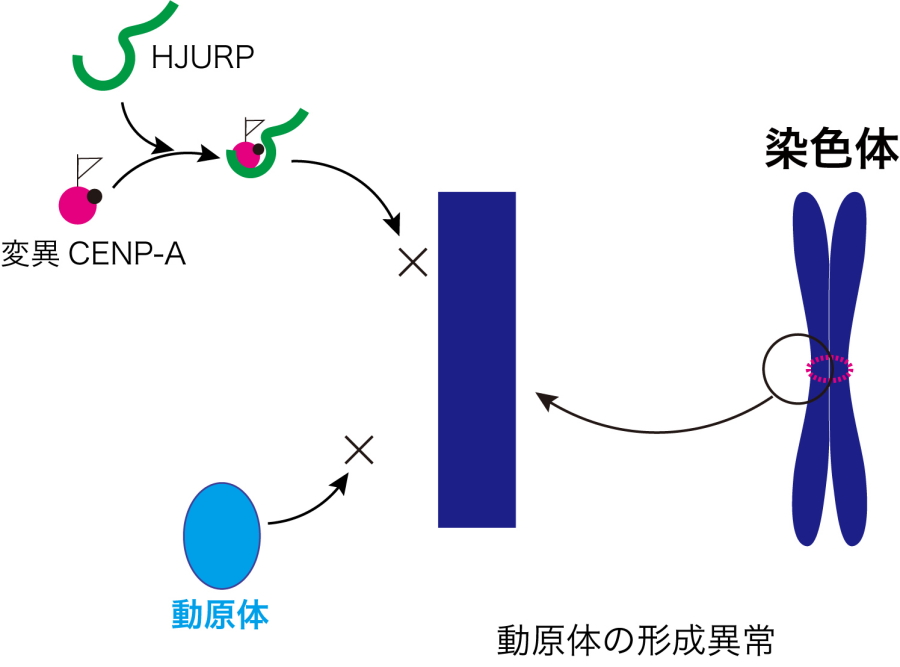
図4.CENP-Aの変異による動原体形成の異常
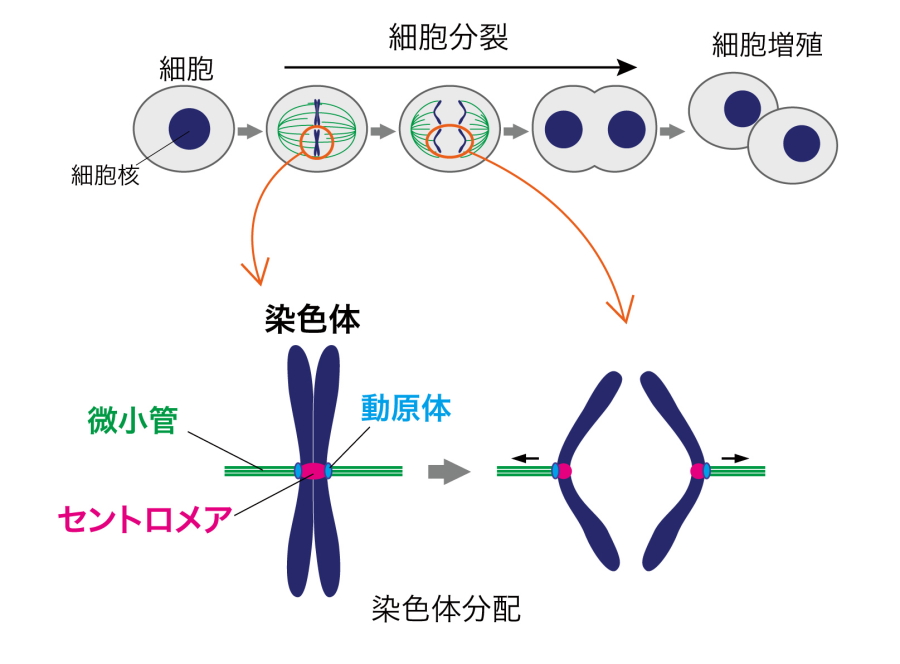
図5.染色体分配
用語解説
- 染色体分配
細胞には、遺伝情報が書き込まれたDNAが複数入っている。これらDNAは、細胞が分裂して増える前に2つにコピーされ、細胞分裂が起こる際にコンパクトに折り畳まれ、染色体と呼ばれる構造を取る。このコピーされた染色体を子孫の細胞に均等に受け渡すことを染色体分配という。(図5) - CENP-A
ヒストンと呼ばれるDNA結合タンパク質の1種。真核生物では、大部分の染色体上には、H3というヒストンタンパク質を含むヒストン複合体が存在しDNAと強固に結合しているが、染色体のセントロメア領域には、H3タンパク質の代わりにCENP-Aを含むヒストン複合体が存在して、動原体を形成する目印として働く。 - 動原体
染色体上に形成される巨大なタンパク質複合体。細胞分裂が起こるとき、染色体を引っ張る糸(微小管)と結合し、染色体と微小管との結合を仲介することで染色体分配の過程で重要な働きをする。 - 微小管
真核生物の細胞内に存在する主要な細胞骨格の一つ。チューブリンというタンパク質が繊維状につながった直径約25nmの管状の構造であり、細胞の形態維持や変化、細胞内の物質輸送、細胞分裂など多様な機能に重要な役割を果たしている。 - セントロメア
動原体が形成される染色体上の特殊な領域。通常、染色体あたり1カ所存在し、その領域には生物種に固有なDNA配列が高度に反復した構造がある場合が多い。 - HJURP
CENP-Aタンパク質と結合して、染色体のセントロメア領域にCENP-Aの目印を入れる過程をサポートするタンパク質。
| 原著論文 | Cell Reports (2020) |
|---|---|
| 論文タイトル | Essentiality of CENP-A depends on its binding mode to HJURP |
| 著者 | Tetsuya Hori (1), JingHui Cao (1), Kohei Nishimura (1), Mariko Ariyoshi (1), Yasuhiro Arimura (2), Hitoshi Kurumizaka (2), Tatsuo Fukagawa (1)
|
| PubMed | 33207191 |
