生後の「脳」の発達にDNA修復システムが不可欠だった
突然変異を起因とする精神神経疾患の理解に新たな糸口
| 原著論文 | J. Neurosci. (2020) |
|---|---|
| 論文タイトル | Suppression of DNA Double-Strand Break Formation by DNA Polymerase β in Active DNA Demethylation is Required for Development of Hippocampal Pyramidal Neurons |
概要
大阪大学大学院生命機能研究科の菅生紀之特任准教授(常勤)、当時大学院生の植田尭子さん(博士課程)、八木健教授、山本亘彦教授らの研究グループは、藤田医科大学の宮川剛教授らの研究グループと共に、DNA修復酵素の一つであるPolβが生後発達初期の海馬神経細胞の分化に作用し、学習・記憶の回路形成に重要な役割を担うことを明らかにしました。さらに、その分子メカニズムとして、エピジェネティクスの遺伝子発現制御の1つである能動的DNA脱メチル化経路においてPolβ依存的なDNA修復が重篤なDNA損傷であるDNA2本鎖切断の形成を抑制していることも明らかになりました。これまで、生後の神経細胞におけるPolβの役割に関しては全く明らかになっていませんでした。本研究により、初めて生後発達初期の神経細胞分化における能動的DNA脱メチル化においてPolβがゲノム安定維持に寄与すること、さらにこの過程は正常な脳機能構築に必要であることが明らかになりました。今後、精神神経疾患の原因となるDNA損傷に起因した体細胞突然変異の発生メカニズムの理解に繋がることが期待されます。
研究の背景
遺伝情報の源であるゲノムDNAは、核内で常に損傷の危険に曝されていますが、それに対して細胞にはDNA修復のメカニズムが備わっています。その破綻は、細胞死や突然変異が蓄積されることで癌や免疫不全といった疾患に繋がることが知られています。一方、脳の病気である発達障害や自閉症といった精神神経疾患も遺伝子の突然変異に起因することが明らかとなってきました。しかし、発生発達過程でいつどのようにして突然変異が生じるかに関してはほとんど明らかになっていません。DNA修復は、損傷の構造に対応して数多くの酵素が役割分担をすることで強固なシステムを構成しています。DNAポリメラーゼβ(Polβ)もその一つで、塩基損傷を修復する塩基除去修復経路の一端を担っています。近年、この修復経路がエピジェネティクスな遺伝子発現制御の1つである能動的DNA脱メチル化の過程に含まれることが明らかになっています。これまでの研究では、Polβを完全に欠損したマウスは出生直後に呼吸不全により致死となることから、胎生期の神経発生での役割を報告してきました(Onishi K, et al., J. Neurosci, 2017)。しかし、その一方で生後の神経細胞分化や脳機能に及ぼす影響に関しては全く不明でした。
本研究の成果
この問題を明らかにするために、本研究グループは生後の脳におけるPolβの時空間的な役割を明らかにする研究を行いました。大脳特異的に最終分裂後の興奮性神経細胞でPolβを欠失する遺伝子改変マウス(Nex-Cre/Polβf/f)を作製して調べた結果、出生後2週間ほどの発達初期段階で学習・記憶を司ることが知られる海馬神経細胞の核内に重篤なDNA損傷であるDNA2本鎖切断が数多く引き起こされることを発見しました(図1)。この損傷は一過的に増加し細胞死までには至らないものの、遺伝子発現や樹状突起形成に異常をもたらすことを明らかにしました(図2)。この分子メカニズムとして細胞分化に関わる能動的DNA脱メチル化との関係を調べたところ、生後発達初期にゲノムDNA中のメチル化シトシン量は大幅に減少していました。さらに、能動的DNA脱メチル化の開始に必要とされるTET酵素の高発現と発現抑制の遺伝子操作を行うと、それぞれDNA2本鎖切断の増加と減少が観察されたことから、Polβはメチル化されたシトシンを除去する際に生じたギャップに新たなシトシンを合成する過程に必要であることが明らかになりました(図3)。この過程が脳機能へ及ぼす影響を調べるために行動解析を行ったところ、遺伝子改変マウスは空間学習・記憶や不安様行動に異常が認められました(図2)。以上のことから、生後発達初期の神経細胞分化における能動的DNA脱メチル化にPolβ依存的DNA修復によるゲノム安定維持が必要であり、正常な脳機能の構築に貢献していることが初めて明らかになりました。
本研究によって、Polβが生後発達初期の神経細胞分化と回路構築に不可欠であることが明らかになりました。このことは、ゲノム安定性を維持するDNA修復酵素システムが、正常な脳の機能構築に貢献していることを示唆しています。今後、この神経細胞分化におけるDNA修復と体細胞突然変異の基礎研究を新たな糸口として、脳形成や精神神経疾患の発症原理の理解に繋がることが期待されます。
研究成果のポイント
- DNA修復酵素の一つであるDNAポリメラーゼβ(Polβ)が、生後発達初期の海馬神経細胞における分化メカニズムとしてDNA損傷を抑制することを発見しました。
- Polβは、神経細胞分化においてゲノムDNAのメチル化修飾を制御する能動的DNA脱メチル化による遺伝発現調節に寄与しています。
- 生後発達初期のPolβ機能不全は、成体での学習・記憶能力の低下や不安様行動に繋がります。
研究者のコメント
今回の研究では、生後約2週間という限られた時間窓でのDNA修復の役割が、成体になった脳の機能に不可欠であることがわかりました。しかし、なぜ脳形成に重要な発達初期においてゲノムDNAを傷つけるメカニズムが分化プログラムに組み込まれているのかに関してはまだまだ未知の領域です。今後も脳の形成や病気の理解に貢献できるように、研究室のメンバーと共に基礎研究を続けたいと思います。(菅生紀之)
特記事項
本研究成果は、米国科学誌「Journal of Neuroscience」に、10月21日(日本時間)に公開されました。
なお、本研究は、日本学術振興会科学研究費補助金と日本医療研究開発機構研究費の一環として行われました。

図1.生後15日目海馬神経細胞に観察されるDNA2本鎖切断
Polβを破壊した神経細胞は、生後発達初期にDNA2本鎖切断の蓄積が観察される。黄緑色の輝点は、DNA2本鎖切断部位に集積するγH2AXの免疫染色象を示す。点線は、核の輪郭を示す。
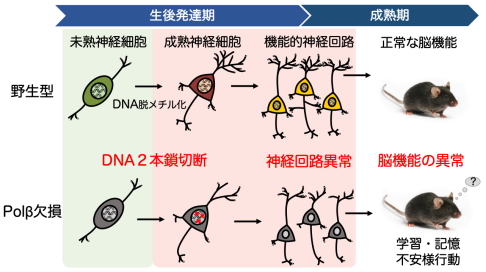
図2.神経細胞におけるPolβ欠失が脳形成・機能に与える影響
神経細胞でPolβを欠失すると生後発達初期の海馬神経細胞にDNA2本鎖切断を生じ、遺伝子発現や回路形成に異常が生じる。その結果として、成体での学習・記憶や不安様行動に影響が及ぶ。
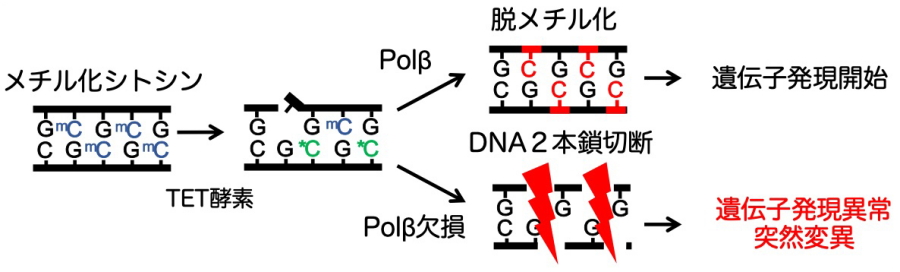
図3.神経細胞分化におけるPolβ依存的能動的DNA脱メチル化
用語解説
- 能動的DNA脱メチル化
ゲノムDNAでシトシンは可逆的にメチル化修飾される。メチル化シトシンは遺伝子発現に抑制的に働き、脱メチル化を受けることで活性化することが知られている。能動的脱メチル化の反応経路は、TET酵素による修飾によって開始され、その後塩基除去修復の経路を使ってメチル化シトシンを除去してシトシンを再合成することで完了する。一方、DNA複製時のDNA合成によってシトシンに変換される経路を受動的DNA脱メチルという。 - エピジェネティクス
DNAの塩基配列の変化を伴わずに遺伝子発現を調節するメカニズム。神経細胞では、発生分化の調節メカニズムの一つとして知られている。 - DNA2本鎖切断
DNA損傷の中でも重篤であり、DNA2本鎖両方のヌクレオチド鎖のホスホジエステル結合が切断される。細胞は修復メカニズムを備えているが、ヌクレオチドの挿入・欠失といった突然変異が生じやすいことが知られている。ゲノム編集による変異導入は、この細胞特性を利用している。 - 体細胞突然変異
生殖細胞以外の体細胞のゲノムDNAに生じた突然変異。脳においては体細胞突然変異を持った神経細胞がモザイク状に存在していることが知られており、精神神経疾患の脳では、変異を持った神経細胞の割合が高くなることが観察されている。 - 塩基除去修復
DNA修復経路の1つで、活性酸素種などによりDNAの塩基に受けた損傷を修復する反応経路。損傷を受けたヌクレオチドは除去され、DNAポリメラーゼによって再合成されることで修復される。Polβはこの反応経路で機能するDNA ポリメラーゼの一つである。
| 原著論文 | J. Neurosci. (2020) |
|---|---|
| 論文タイトル | Suppression of DNA Double-Strand Break Formation by DNA Polymerase β in Active DNA Demethylation is Required for Development of Hippocampal Pyramidal Neurons |
| 著者 | Akiko Uyeda (1), Kohei Onishi (1), Teruyoshi Hirayama (1, 2), Satoko Hattori (3), Tsuyoshi Miyakawa (3), Takeshi Yagi (1, 2), Nobuhiko Yamamoto (1), Noriyuki Sugo (1)
|
| PubMed | 33087478 |
