生命の遺伝情報継承に重要な相同染色体対合を促進する仕組みを発見
染色体異常に起因するダウン症や流産など将来における原因解明へ期待
| 原著論文 | Nat. Commun. 10(1):5598 (2019) |
|---|---|
| 論文タイトル | Chromosome-associated RNA-protein complexes promote pairing of homologous chromosomes during meiosis in Schizosaccharomyces pombe |
| 研究室サイト | 細胞核ダイナミクス研究室 |
概要
国立研究開発法人情報通信研究機構(NICT、理事長:徳田英幸)と国立大学法人大阪大学(大阪大学、総長:西尾章治郎)は共同で、分裂酵母において、遺伝情報を組み換える際に行われる相同染色体の対合という、生命の存続、継承や進化に極めて重要な意味を持つ生命現象を確実かつ安全に行う仕組みを新たに発見しました。
今回、NICT未来ICT研究所及び大阪大学大学院生命機能研究科は、この相同染色体の対合に関与する新たな遺伝子領域とそこに結合する転写終結因子タンパク質を複数発見しました。さらに、その遺伝子領域から転写される長鎖非コードRNAと転写終結因子タンパク質との複合体が引き起こす液-液相分離という物理現象が、染色体対合に重要な役割を担っていることを発見したのは、世界で初めての成果です。
相同染色体対合の仕組みを解明することは、染色体異常に起因するダウン症などの病気や流産の原因解明に貢献することが期待されます。
研究の背景
NICTは、生命進化の成果に学び、未来社会を拓く新しい情報通信パラダイムの創出につながる基礎となる研究を実施しています。
ヒトを含む全ての真核生物は、生殖細胞(精子や卵子等)を作り出す際に、減数分裂と呼ばれる特殊な細胞分裂を行っています。この減数分裂の際に、父母に由来する同種の2本の染色体(相同染色体)が接合(対合)し、遺伝情報の組換えを効率的に行います。これは、生命に進化と多様性をもたらす生物学的に極めて重要な現象です。しかし、相同染色体がどのように対合する相手を認識して接合するかということについて、これまで明らかにされていませんでした。
これまで、NICTは、2009年に相同染色体の構造変化メカニズムに関する新たなタンパク質を発見し、2012年に第2染色体sme2領域において高頻度で相同染色体が対合することを発見し、その領域から転写される非コードRNAが重要な役割を果たしていることを発見するなど、相同染色体のメカニズムの解明に関する最先端の研究を行ってきました。
本研究の成果
今回、NICT未来ICT研究所の丁主任研究員は、大阪大学大学院生命機能研究科の平岡教授との共同研究により、分裂酵母を生きた状態で観察し、相同染色体が高頻度に対合する染色体領域として、以前発見した領域に加え、新たに第1染色体A55領域及び第3染色体C24領域を発見しました。さらに、A55領域からはomt3RNA、C24領域からはlncRNA584という長鎖非コードRNAが合成されることも発見しました。
観察には、分裂酵母の染色体の特定領域が光るようにした上で、独自に開発したイメージング技術を用いました(図2参照)。
減数分裂の際、相同染色体のA55領域からはomt3RNA、またC24領域からはlncRNA584という長鎖非コードRNAが合成され、染色体上に蓄積します。この場所に局在するタンパク質を、独自開発した分裂酵母GFP融合タンパク質ライブラリーから検索した結果、転写終結因子10個を発見しました。更に解析を行った結果、そのうち6個を、相同染色体対合に必須な働きをするタンパク質(Smpタンパク質)と特定しました。
また、これら6個のタンパク質は、長鎖非コードRNAと共に液-液相分離を起こす液滴を形成します。同じRNAを含む液滴のみが融合できることで、相同染色体の相互認識と対合を促進することを明らかにしました(図3参照)。転写終結因子が、非コードRNAと共に形成した液-液相分離した液滴を、染色体上にトラップするようにつなぎ留め、非コードRNAが液滴に特異性を与え、相同染色体の相互認識の決め手になることを発見したことは世界で初めての成果です。
今回の成果によって、生物が子孫を残す過程として重要な相同染色体対合の仕組みの一部が明らかになりました。今回発見したタンパク質は、ヒトを含むほぼ全ての真核生物に保存されていることから、真核生物共通の仕組みである可能性が高いです。したがって、ヒトの精子や卵子が形成される際にも、同様のタンパク質や仕組みが働いている可能性があります。今後、解析が進むことにより、ヒトの精子や卵子が形成されるメカニズム解明への貢献が期待されます。
また、相同染色体の対合が液-液相分離という物理的な現象で説明できることを発見したことは、生物種の種類によらない普遍的な仕組みを示している可能性があり、生物の持つ、子孫への遺伝情報伝達の仕組みの全容解明に向けた大きな前進となります。
これにより、染色体異常に起因するダウン症や流産の原因解明に貢献することが期待されます。
研究成果のポイント
- 生物の遺伝に重要な相同染色体の対合に関与する新たな遺伝子領域と結合するタンパク質を発見
- 液-液相分離という物理的現象が相同染色体の相互認識と対合の促進に重要であることを発見
- 遺伝情報伝達の仕組み解明に大きく前進、ダウン症などの染色体異常の原因解明に期待
本研究成果が社会に与える影響(本研究成果の意義)
今後は、今回発見したRNAやタンパク質が、どのように液-液相分離現象を引き起こすか、そのメカニズムを解明するとともに、RNAやタンパク質などの生体分子を利用したバイオセンサー等、生物が持つ優れた特徴を取り入れたロバストネスな情報通信技術への応用につなげていきます。
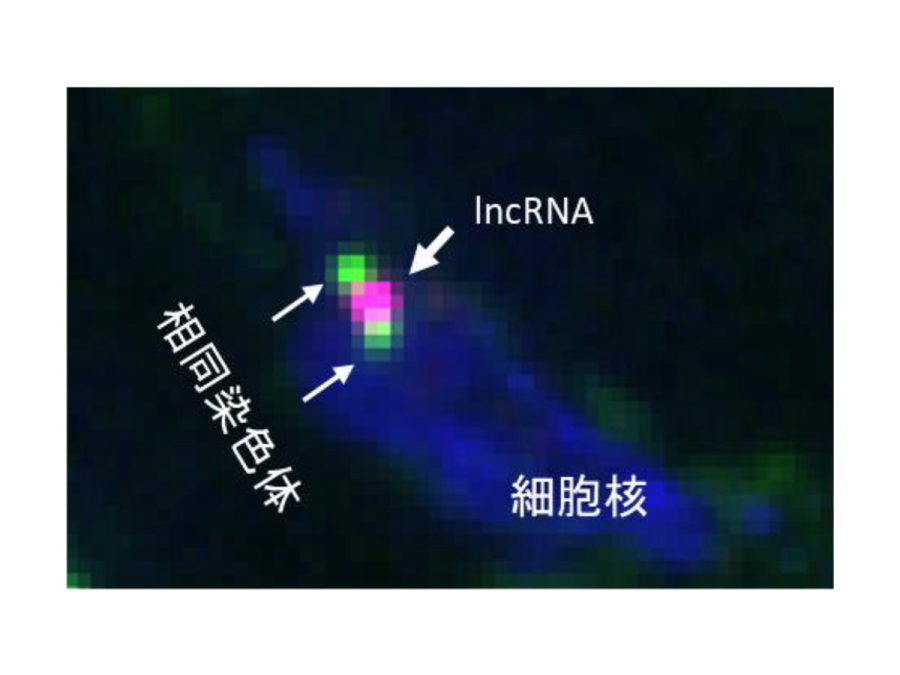
図1.
NICTのイメージング技術によって観察された
相同染色体(緑)をつなぐ長鎖非コードRNA(lncRNA)(赤)液滴の様子
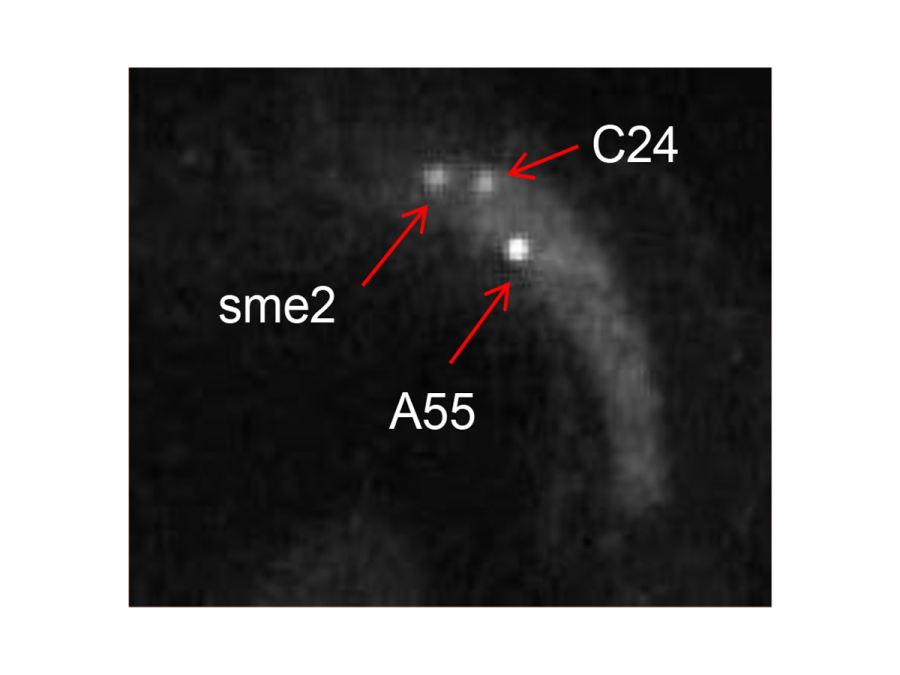
図2.
Smpタンパク質(白い点)が、sme2領域及び新たに発見した高度に対合する染色体領域A55領域とC24領域に集積する様子
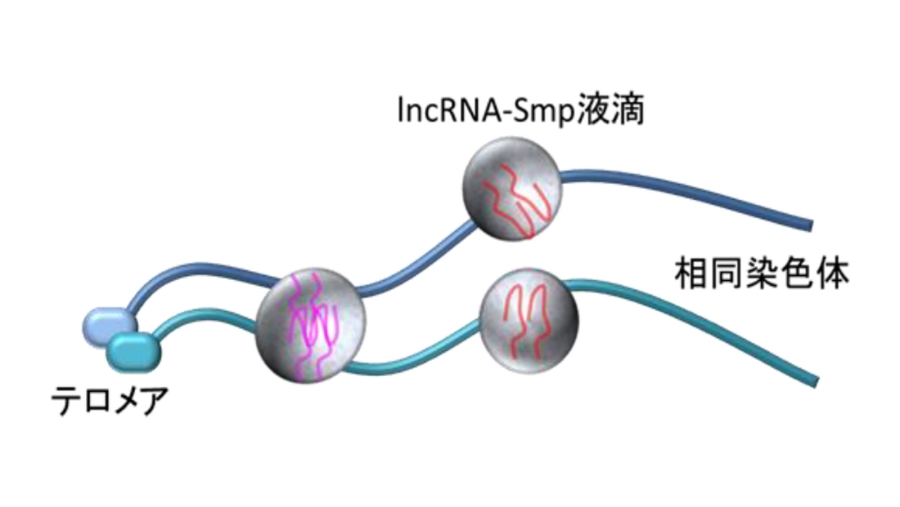
図3.
LLPSで形成された長鎖非コードRNA(lncRNA)とSmpタンパク質の液滴によって相同染色体の相互認識が果たされる
図4.
DNA・染色体構造の簡易イメージ図
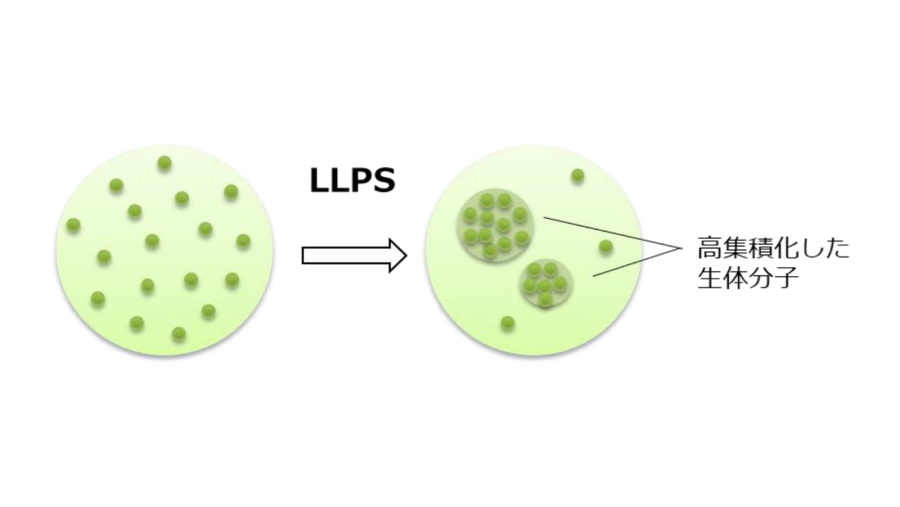
図5.液―液相分離の原理の模式図
左図は緑色の粒(生体分子)が分散して存在する状態を示すのに対して、右図は、液-液相分離(LLPS;高集積化した生体分子と周りの液体成分が2相に分離する)により、緑色の粒が集合して大きな塊(構造体)を形成している。この塊の中では、分散した溶液では起こらない反応が起こることが知られている。
図6.減数分裂イメージ図
染色体数1セット2本のみの簡易モデル
用語解説
- 遺伝情報(DNA、遺伝子、染色体)
生物の形や性質、特徴を次世代に伝えるための情報。物質としては、塩基・リン酸・デオキシリボースの3つの成分から成る2重らせん構造をした化学物質を「DNA(デオキシリボ核酸)」といい、生物の遺伝情報は、このDNAに書き込まれている。DNAは、繊維状の構造を形成し、極めて高密度に折り畳まれ、細胞の核の中に収納されている(ヒトの場合、1つの核の中に約2メートルのDNAが収められている。)。細胞分裂の際には、より一層、高密度に集合することで棒のような形状となり、これを「染色体」という。生命活動に不可欠なタンパク質を作るための設計情報は、DNAに塩基の配列として書き込まれており、このDNA上の領域を「遺伝子」という。DNAには複数の遺伝子が存在する。なお、真核生物のDNAには、タンパク質の設計情報を持たない遺伝子以外の領域が非常に多く存在することが知られているが、近年、この領域からRNA(リボ核酸)が合成されることが発見され、遺伝子の働きを調節する重要な役割を担っていると考えられている。 - 相同染色体の対合と遺伝情報の組換え
ヒトを例にとると、1つの細胞には46本の染色体(うち2本は性染色体)が存在するが、これは、父母それぞれから1セット23本ずつ受け継いだものである。性染色体を除く22本ずつの染色体は、塩基配列がほとんど同じ(同じ形質・性質)もので対合相手となっており、これを相同染色体という。相同染色体は、減数分裂の際、互いに対合相手を認識し、物理的に接着(対合)して二価染色体を形成する。これによって、効率的に遺伝情報を組み換え、生物に遺伝的多様性をもたらしている。一方、相同染色体の対合が正常に行われないと、そのあとの相同組換えが効率よくできなくなり、染色体異常の頻度が上がる。染色体異常に起因する病気(ダウン症等)や流産の原因にもなる。 - 転写、転写終結因子タンパク質
DNAに記載された遺伝情報を基にタンパク質が合成されるが、この仲立ちをRNA(リボ核酸)が行う。遺伝子に記載されたタンパク質の設計情報は、一旦mRNA(メッセンジャーRNA)にコピーされる(これを「転写」という)。mRNAは、コピーしたタンパク質の設計情報を核の外に運び出し、タンパク質を合成する(これを「翻訳」という)。転写を終わらせるために、DNA上に書かれている休止コードを認識するタンパク質や、mRNAをDNAから離して、さらに加工する一連のタンパク質を転写終結因子という。 - 長鎖非コードRNA(lncRNA: long non-coding RNA)
タンパク質に翻訳されずに機能するRNA(リボ核酸)を非コードRNAといい、長さが200ヌクレオチド程度と比較的長い非コードRNAを長鎖非コードRNAという(ヌクレオチドは、ヌクレオシド(塩基と糖)にリン酸が付いたもの)。近年、多くの非コードRNAが発見され、生命活動にとって、従来考えられていたよりもはるかに重要な役割を担っていると考えられるようになった。多様な生理機能を持つとされている一方、機能不明のものが多数である。 - 液-液相分離(LLPS)
液-液相分離(liquid-liquid phase separation, LLPS)は溶液が均一に混じり合わず、2相に分離し安定に存在する物理現象。細胞の複雑な構造(例えば、細胞核内に形成される顆粒など)がLLPSの原理によって形成されることが近年発見され、また、多くの細胞現象にLLPSが関わることで高い注目を浴びている。 - 減数分裂
生殖細胞の形成の際に行われる細胞分裂の形態。1度の染色体の複製で、2度の細胞分裂(第1減数分裂と第2減数分裂)を行い、染色体数が半分の生殖細胞を形成する(受精すると元の染色体数に回復する)。 - sme2
suppressor of mei2の略。sme2遺伝子からはmeiRNA-Lという長さ1500ヌクレオチドの長鎖非コードRNAが転写され、それがsme2遺伝子座上に蓄積され、相同染色体の対合を強く促進する。sme2遺伝子配列を欠失すると、対合頻度は通常のレベルになり、sme2遺伝子配列を別の染色体部位に移動させると、その部位が高い対合頻度を示すようになることから、sme2遺伝子座位に形成されるRNAを含む複合体が、相同染色体の相互認識と対合に関わっていることが明らかになった。 - omt3RNA
分裂酵母の第1染色体のA55領域から転写される長鎖非コードRNAの一つ。1001ヌクレオチドの長さの非コードRNAが発現する。相同染色体対合を促進する以外の機能が報告されていない。 - lncRNA584
分裂酵母の第3染色体のC24領域から転写される長鎖非コードRNA の一つ。2229ヌクレオチドの長さの非コードRNAが発現する。相同染色体対合を促進する以外の機能が報告されていない。 - GFP融合タンパク質ライブラリー
GFP(Green Fluorescent Protein、緑色蛍光タンパク質)はオワンクラゲが持つ蛍光タンパク質で、下村博士がGFPの発見で2008年ノーベル化学賞を受賞した。GFPと他のタンパク質を融合させて蛍光を観察することによって、そのタンパク質の細胞内局在を調べることができる。GFP遺伝子が組み込まれるクローンコレクションをGFPライブラリーという。NICTはこれまでに2つの分裂酵母GFPライブラリーを構築し、公開している。https://www2.nict.go.jp/frontier/seibutsu/CellMagic/gfplibsum.htm
| 原著論文 | Nat. Commun. 10(1):5598 (2019) |
|---|---|
| 論文タイトル | Chromosome-associated RNA-protein complexes promote pairing of homologous chromosomes during meiosis in Schizosaccharomyces pombe |
| 著者 | Da-Qiao Ding (1), Kasumi Okamasa (1), Yuki Katou (2), Eriko Oya (3, 4), Jun-Ichi Nakayama (3, 5), Yuji Chikashige (1), Katsuhiko Shirahige (2), Tokuko Haraguchi (1, 6), Yasushi Hiraoka (1, 6)
|
| PubMed | 31811152 |
