受精卵の中で人工細胞核構造の構築に世界で初めて成功
細胞核が形成される仕組みの一端を明らかに
| 原著論文 | Sci. Rep. 9(1):8461 (2019) |
|---|---|
| 論文タイトル | Nuclear Formation Induced by DNA-conjugated Beads in Living Fertilised Mouse Egg |
| 研究室サイト | 細胞核ダイナミクス研究室 |
概要
近畿大学生物理工学部(和歌山県紀の川市)、情報通信研究機構(東京都小金井市)、大阪大学(大阪府吹田市)の研究グループは、生命の基本設計図である「DNA」に着目して、DNAを結合させた微小ビーズ(DNAビーズ)をマウス受精卵の細胞質内に導入することでどのような生命現象が起こるかを観察し、人工的に細胞核構造を造り出すことに世界で初めて成功しました。本成果は、生物の発生開始の仕組みの一端が明らかとなるとともに、受精後に細胞核が形成されるプロセスの仕組みの一端を明らかにし、将来的には不妊症の原因解明に貢献することが期待されます。
真核生物において、細胞核は生命現象を司るDNAを保持し、働かせ、伝達させるために、細胞が分裂増殖するたびに崩壊と再構築を繰り返す動的な細胞小器官として知られています。しかし、その精巧な構造体がいかにして毎回規則正しく形成され、機能性を獲得するようになるのか、その仕組みを担う発端の要素を解析した報告は多くはありませんでした。そこで本研究では、最初に細胞核が形成される「受精卵」をモデルにして、細胞核形成に必要な既知の材料を生きたマウス受精卵の細胞質内に導入し、人工的な細胞核が構築される過程を「生きたまま」観察することを試みました。具体的には、既知の材料として、生命の基本設計図である「DNA」に着目し、DNAを結合させた微小ビーズ(DNAビーズ)を細胞質内に導入することで、その周囲でどのような生命現象が起こるかを観察しました。その結果、DNAビーズ周囲にはヒストンが集積してヌクレオソーム構造が形成されるのに加え、核膜・核膜孔複合体が呼び込まれて人工核構造が再構築されることが明らかとなりました。
しかしながら人工核構造は、細胞質から核内へタンパク質を運ぶ「核移行活性」機能の獲得には至っておらず、その周囲には、タンパク質輸送に関わるRan因子も存在しませんでした。このことから、核膜孔複合体の構造が不完全もしくは、輸送に関与するタンパク質が何らかの要因により機能していない可能性が示唆されました。
本研究は、マウス受精卵を「生きた試験管」と見立て、その中で人工細胞核構造を構築することに世界で初めて成功したものです。これは、受精後に細胞核が形成されるプロセスの仕組みの一端を明らかにしたと言えます。この成果は、受精直後に何らかの問題があるような不妊症の原因解明に道を開きます。
研究の背景
真核生物において、細胞核は染色体を核膜で包むことで構成されています。また、遺伝子を働かせ、それらの情報を正確に伝えるために、細胞核は細胞周期依存的に規則的な崩壊と再構築を繰り返しますが、有糸分裂で一旦崩壊した核がどのような仕組みで再び構築されるのか、不明な点が多く存在します。これまでの細胞核形成に関する研究のほとんどは、カエルの卵母細胞の抽出物を用いた実験であり、細胞をすりつぶして得た抽出物(エキス)を使ったり、細胞を固めて染めたりする方法で解析されていたため、ある時点の情報しか得られませんでした。
この問題を解決するべく、情報通信研究機構 未来ICT研究所の原口は大阪大学の平岡との共同研究により、直径約3μmのDNAビーズを生きた哺乳動物の培養細胞に導入することで細胞核の再構成研究に取り組んできました(Kobayashi et al, PNAS, 2015)。しかし、培養細胞では導入したDNAがヌクレオソーム構造を取ることはなく、核構造の構築には至りませんでした。そこで今回、近畿大学の山縣らは、このDNAビーズをマウス受精卵の細胞質内に導入し、免疫蛍光法、ライブセルイメージング技術、電子顕微鏡観察を駆使して、生きたまま受精卵全体を観察する方法で、細胞核ができ上がる様子を時間を追って細胞の中を観察する「時間軸・空間軸を加えた解析」により、機能的な人工核が再構築されるかを評価しました。
本研究の成果
- マウス受精卵へのDNAビーズ導入法の確立
マウス受精卵へのDNAビーズ導入法として、マイクロインジェクション技術を用いました(図1)。DNAビーズを導入した受精卵はその後、正常に卵割を繰り返す様子が観察されたことから、DNAビーズに対する細胞応答を経時的に観察・評価できることが示唆されました。 - DNAビーズ周囲へのヒストン集積およびヌクレオソーム構造の観察
細胞核内でゲノムDNAは高次構造を取って収納されています。そこで、DNAビーズ上のDNAがどの程度高次構造を取るかを評価しました。最初に、DNAがヒストンに巻かれるかを調べるために、免疫染色およびライブセルイメージング技術を用いてDNAビーズ周囲へのヒストンの集積を確認したところ、4種類のコアヒストンの集積が観察されました。次に、集積したコアヒストンがヌクレオソーム構造を形成するかを確認したところ、ヌクレオソーム特異的に結合するRCC1因子がDNAビーズ上に局在することが明らかとなりました。この結果は以前に原口らが培養細胞で行った時には見られなかったため、卵子にある特別な核構築能力によるものと考えられます。 - DNAビーズ周囲の核膜および核膜孔様構造の観察
DNAビーズ周囲に膜状の構造が形成されているかを電子顕微鏡観察により評価しました。その結果、二重の膜構造の形成が確認され、更には、膜構造の所々に膜孔構造が存在することが明らかとなりました。核膜孔複合体の構成タンパク質であるヌクレオポリンがDNAビーズ周囲に存在するかを免疫染色により確認したところ、DNAビーズを取り囲むようにそれらのシグナルが観察されました。(図2) - 人工核様構造の核移行活性評価
DNAビーズ周囲において機能的な核膜孔複合体が形成されているかを評価しました。最初に、核膜孔複合体の分子バリア機能を確認しました。大小異なる分子サイズの蛍光デキストランを用いて、核膜孔を介した通過の有無を観察したところ、大きな分子ではDNA領域に蛍光シグナルが見られないことから、人工核構造に存在する核膜孔複合体は大きな分子を単独では通過させない分子バリア機能を有することがわかりました。次に、核移行活性の有無を確認するために、蛍光タンパク質を付加した核移行シグナル(NLS)の人工核様構造への流入を観察したところ、DNAビーズ周囲にシグナルは確認されませんでした。加えて免疫染色により、核移行活性に関与する因子として知られるRanがDNAビーズ周囲に存在しないことがわかりました。
研究成果のポイント
- DNAを含む微小な (直径約3µmの) ビーズを生きたマウス受精卵の細胞質内にマイクロインジェクションすることで、人工的な細胞核構造を造り出すことに世界で初めて成功。
- 構築された人工細胞核では、受精卵の天然の細胞核と同様、DNAがヌクレオソーム構造を形成し、その周りに核膜が形成されていることを確認した。
- 受精卵の中では、DNAの存在を起点として細胞核構造が形成されることが明らかとなり、将来的には不妊症の原因解明に貢献することが期待される。
本研究成果が社会に与える影響(本研究成果の意義)
マウス受精卵の細胞質内にDNAさえ存在すれば、人工核構造が構築されることが明らかとなりました。しかしながら、細胞核としての機能性を獲得させるためには、DNA以外の別の要素が必要であることがわかりました。本研究は、時間軸方向での解析を可能とするため、細胞核がどのように再構築され、いつ機能性を獲得するようになるのか、細胞核形成の仕組みの時系列変化を追究することができます。今後、DNAに別の要素を組み合わせることで、将来的には核移行活性の獲得に加え、転写能を有する人工核を構築し、細胞核形成から機能性獲得までの仕組みを経時的に明らかにすることを目指します。
特記事項
本研究成果は、2019年6月11日(火)18時(日本時間)に「Scientific Reports」(オンライン)に掲載されました。
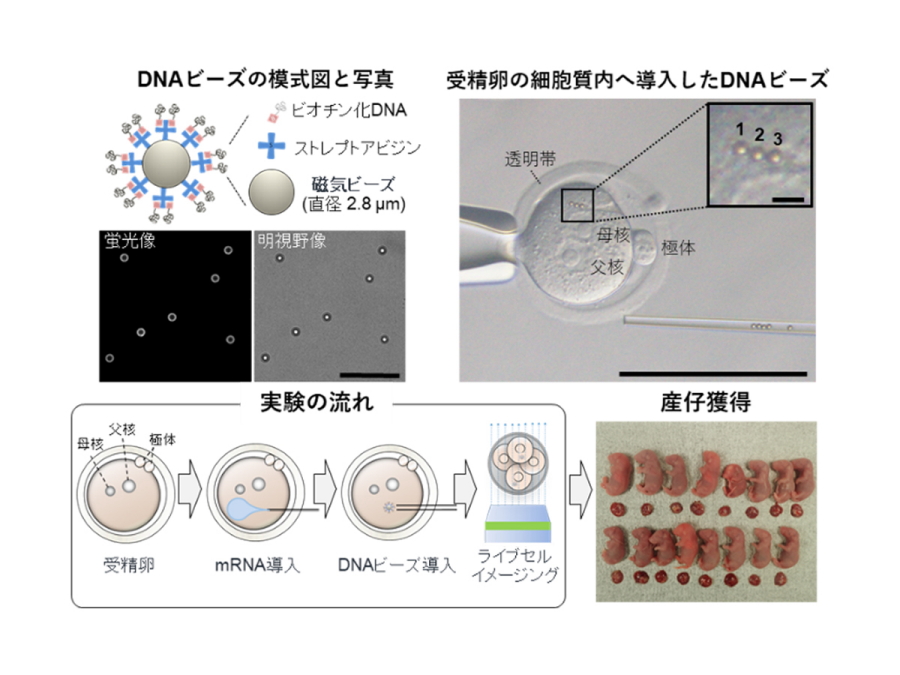
図1.
左上:DNAビーズの模式図およびDNAビーズをヘキスト染色した蛍光像(白:DNA)と明視野像。スケールバー=25μm。
右上:マイクロインジェクション法により受精卵の細胞質内へ導入されたDNAビーズの写真。スケールバー=100μm;5μm(拡大:右上)。
左下:実験の流れ。受精卵の細胞質内に蛍光タンパク質をコードするmRNAを導入した。続いて細胞質内にDNAビーズを導入し、経時的に観察を行った。
右下:DNAビーズを導入した受精卵を仮親に移植して得られた産仔の写真。
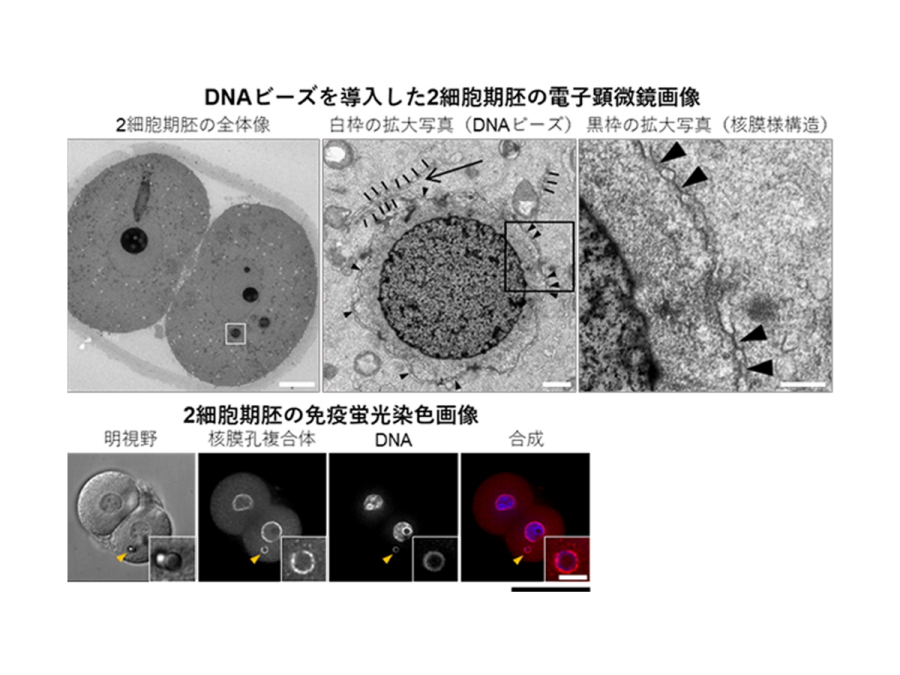
上:DNAビーズを導入した2細胞期胚の電子顕微鏡画像を示す。左は2細胞期胚の全体像。真ん中は白枠(DNAビーズ)の拡大写真。ビーズ周囲には2重の膜様構造が見られ、矢頭は膜孔様構造、矢印は層状の膜構造がビーズに陥入している様子を示す。右は黒枠の拡大写真(膜様構造と膜孔様構造の拡大写真)。スケールバー(左から順に)=10μm、0.5μm、0.2μm。
下:核膜孔複合体の抗体を用いて免疫染色をした2細胞期胚の蛍光画像。矢頭はDNAビーズを示す。スケールバー=50μm、5μm(拡大:挿入図)。
用語解説
- ヌクレオソーム構造
4種類のコアヒストン(ヒストンH2A、H2B、H3、H4)から構成されるヒストン8量体に146bpのDNAが巻き付いた構造。 - ヒストン
細胞核内に存在する主要なタンパク質。DNAに結合し、細胞核を検出する指標となる。 - 核移行活性
細胞質から核内へタンパク質を輸送する機能。 - Ran因子
核移行活性を制御する核内タンパク質。 - 核膜孔複合体
核と細胞質との間の物質輸送を媒介する巨大なタンパク質複合体。 - カエル卵母細胞抽出物
アフリカツメガエルの卵子を遠心分離することにより得られる抽出物。 - 培養細胞
生体外で人為的に培養している細胞。 - 免疫蛍光法
色素のついた抗体を用いて、細胞内における目的のタンパク質の局在を調べる方法。 - ライブセルイメージング
緑色蛍光タンパク質などを用いて、細胞内におけるタンパク質や構造を生きたまま連続的にタイムラプス観察をする手法。本研究では、ヒストンタンパク質を赤色に染めることで細胞核を可視化している。 - 分子バリア機能
分子量の小さいものは通し、大きいものは通さないという核膜の「ふるい」機能。 - 蛍光デキストラン
分子バリア機能の有無を調べるために用いる蛍光物質。分子量の小さいものと大きいものがある。 - 核移行シグナル(NLS)
タンパク質を細胞質から核内へと移行するために必要なアミノ酸配列。
| 原著論文 | Sci. Rep. 9(1):8461 (2019) |
|---|---|
| 論文タイトル | Nuclear Formation Induced by DNA-conjugated Beads in Living Fertilised Mouse Egg |
| 著者 | Yuka Suzuki (1), Şükriye Bilir (2, 3), Yu Hatano (1), Tatsuhito Fukuda (1), Daisuke Mashiko (1), Shouhei Kobayashi (3), Yasushi Hiraoka (2, 3), Tokuko Haraguchi (2, 3), Kazuo Yamagata (1)
|
| PubMed | 31186495 |
