「つぼみ」が開いて輸送開始
べん毛輸送チャネル複合体の先端にキャップ構造を発見
抗菌剤標的としての可能性も
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 122(34):e2507221122 (2025) |
|---|---|
| 論文タイトル | A β-cap on the FliPQR protein-export channel acts as the cap for initial flagellar rod assembly |
概要
大阪大学大学院生命機能研究科プロトニックナノマシン研究グループの南野徹准教授、同研究科日本電子YOKOGUSHI協働研究所の木下実紀特任助教(常勤)、宮田知子特任准教授(常勤)、牧野文信招へい准教授(日本電子)、難波啓一特任教授(常勤)、同大学理学研究科の今田勝巳教授らの共同研究グループは、細菌の運動器官「べん毛」を作るために必要な輸送チャネル複合体の出口ゲートの構造を解明し、花が咲くようにゲートが開いてべん毛形成が開始するしくみを、世界で初めて明らかにしました。
多くの運動性細菌の細胞表層には、べん毛と呼ばれるタンパク質でできた運動器官が存在し、細菌はそれを用いて様々な環境下を移動します。べん毛は、約30種類のタンパク質が段階的に組み上がることで形成されます。べん毛の根本に存在する専用のタンパク質輸送装置が細胞内でできたべん毛の部品を順に細胞外へ送り出します。この輸送装置は、5種類の膜貫通型タンパク質(FlhA、FlhB、FliP、FliQ、FliR)と3種類の可溶性タンパク質(FliH、FliI、FliJ)から構成されます。中でも、FliP、FliQ、およびFliRは複合体(FliPQR)を形成し、べん毛タンパク質を細胞膜の外へと通す輸送チャネル複合体として働きます(図1)。FliPQR複合体には、細胞質側とペリプラズム側にそれぞれ入口ゲートと出口ゲートが存在し、それらのゲートの開閉は厳密に制御されています。しかし、ゲートの開閉の仕組みや、最初に送り出されるFliEと呼ばれるべん毛の部品がどのように配置されてべん毛形成が開始するのかは、長らく未解明のままでした。
今回、共同研究グループは、クライオ電子顕微鏡を用いることでFliPQR輸送チャネル複合体の先端にβシート状の「ふた」のような構造があることを発見し、βキャップと名づけました(図2)。βキャップは、輸送チャネルの出口ゲートをしっかり閉じた状態に保つ役割を果たすだけでなく、最初に輸送されるFliE分子をべん毛形成の開始点へと誘導する機能を持つことも明らかになりました。さらに、次々と輸送されるFliE分子が順にβキャップの構造変化を引き起こし、まるで花が咲くかのように出口ゲートが段階的に開いてべん毛形成が始まるというメカニズムも解明しました。 べん毛は、病原性細菌による感染やバイオフィルム形成にも深く関わっているため、これらの発見は、病原性メカニズムの理解や新たな抗菌標的の探索につながることが期待されます。
研究の背景
これまでの研究により、べん毛タンパク質輸送装置を構成するFliPおよびFliRは、それぞれ細胞膜中で5分子(FliP)と1分子(FliR)が集合してFliPR複合体を形成し、さらにその周囲にFliQが4分子結合することで輸送チャネル複合体が形成されます。この輸送チャネル複合体は、細胞質側とペリプラズム側の両方にゲート構造を持ちます。このうち、ペリプラズム側の出口ゲートは、べん毛の形成が始まる前、つまり最初に輸送されるべん毛タンパク質であるFliE分子が輸送されるまでは、完全に閉じている必要があります。しかし、クライオ電子顕微鏡による解析でこれまでに明らかになった輸送チャネル複合体の構造では、出口ゲート先端付近の構造が壊れて開いていました。そのため、出口ゲートはどのように閉じているのか、ゲートがどのように開いてべん毛形成が開始するのかといったことは、未解決のままでした。
本研究の成果
共同研究グループは、輸送チャネル複合体の出口ゲートが壊れた原因はクライオ電子顕微鏡観察時に用いる界面活性剤であると考え、輸送チャネル複合体をペプチディスクに再構成し、その構造をクライオ電子顕微鏡により構造解析を行いました。その結果、これまで構造が不明であった出口ゲート全体を高分解能で可視化し、原子モデルの構築に成功しました(図2)。出口ゲートの先端では、5分子のFliPと1分子のFliRのアミノ末端領域がそれぞれβ構造を形成し、これらが集合してつぼみの先端のような「βキャップ」と名付けたふた構造を形成していました。このβキャップによって、出口ゲートはしっかりと閉じた状態に保たれていることがわかりました。
さらに、βキャップには、べん毛形成の開始点付近に、べん毛形成の最初に輸送されるFliE分子が1分子だけが通過できる小さな隙間が存在することもわかりました。このことから、βキャップは最初のFliE分子をべん毛形成の開始点へ誘導する機能を持つことも明らかになりました。そして、輸送されたFliEが固定されると、βキャップと輸送チャネル複合体の一部が開き、その結果、次のFliE分子が組み込まれるための新たな結合部位が形成されることも明らかになりました。以上の結果から、FliEの輸送と同期して、つぼみが花開くように一枚一枚の花びらが順に開くイメージで、出口ゲートが段階的に開くという新しい開口メカニズムを発見しました(図3)。
本研究は長年未解明であった輸送チャネルの出口ゲートの開口しくみを世界で初めて解明しました。
研究成果のポイント
- クライオ電子顕微鏡を用いてべん毛タンパク質輸送チャネル複合体の高分解能立体構造を解明。
- べん毛タンパク質輸送装置を構成するFliP、FliQ、およびFliRで形成されるFliPQR複合体には、入口ゲートと出口ゲートが存在し、開閉は厳密に制御されているが、開閉の仕組みやべん毛形成開始の仕組みは長らく未解明であった。
- チャネルの出口ゲートの先端部に、閉じたつぼみの先のようなキャップ構造を発見し、花びらが1枚1枚開くようにチャネルの出口ゲートが段階的に開いてべん毛タンパク質の輸送とべん毛形成が始まる精巧なしくみを解明。
- 細菌の運動性や病原性に関わるタンパク質輸送機構の理解が進み、新たな抗菌剤の開発やナノテクノロジーへの応用に期待。
本研究成果が社会に与える影響(本研究成果の意義)
サルモネラ感染症の患者数は、世界中で毎年7,500万人にのぼり、年間およそ27,000人が命を落としています。細菌感染症の治療には抗菌剤が広く用いられていますが、近年は多剤耐性菌の出現により、従来の治療が効かないケースが増加しています。世界保健機関の報告によると、2050年には細菌感染症の死者数がガンを上回ると予想されており、既存の抗菌剤に代わる新たな治療戦略の開発が緊急の課題となっています。
細菌のべん毛運動は、病原性の発現やバイオフィルム形成に深く関与していることが知られています。べん毛タンパク質輸送装置は細菌に特有の分子機構で、しかも細菌の生存には必須ではないため、その機能のみを選択的に阻害できる薬剤が開発できれば、病原細菌のべん毛運動性や感染力を効果的に抑制できる可能性があります。
本研究成果により、入口ゲートの開閉機構という未解明の課題への研究がさらに進展することが期待できます。また、FliPQR輸送チャネル複合体の詳細な立体構造が明らかとなったことで、この装置を直接ターゲットとした創薬スクリーニングが可能となりました。今後、FliPQR複合体に結合してその機能を阻害する化合物を同定することで、新興細菌感染症の制御を資する新たな治療薬の開発が大きく前進すると期待されます。
研究者のコメント
べん毛輸送チャネル複合体の先端に存在するβキャップは非常に不安定な構造で、生体膜から界面活性剤を用いて取り出すと、すぐに壊れるという課題がありました。今回、私たちはこの輸送チャネル複合体をペプチディスク内に再構成することにより、βキャップを安定化させることに成功しました。これにより、これまで観察が困難であったβキャップを初めて可視化し、その存在を明確に示すことができました。(南野徹)
特記事項
本研究成果は、2025年8月21日(木)午前4時(日本時間)に米国科学誌「米国アカデミー紀要 (Proceedings of the National Academy of Sciences of the United States of America」(オンライン)に掲載されました。
なお、本研究は、日本学術振興会科学研究費補助金JP20K15749、JP22K06162(木下実紀)、JP19H03182、JP22H02573、JP22K19274(南野徹)、文部科学省科学研究費補助金JP20H05532、JP22H04844(南野徹)、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)課題番号JP19am0101117、JP21am0101117(研究代表者:難波啓一)、および医療研究開発革新基盤創成事業(CiCLE)課題番号JP17pc010102(研究代表者:難波啓一)の助成を受けたものです。
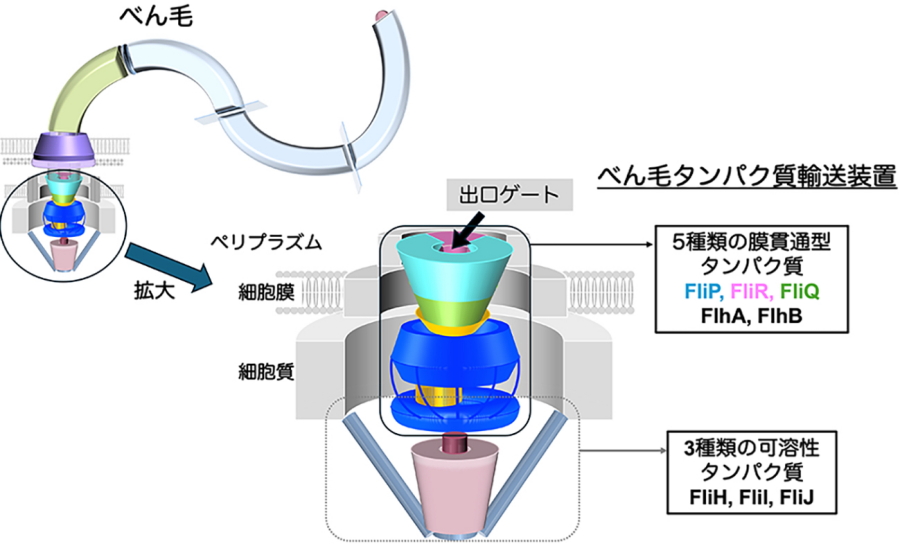
図1.細菌べん毛とその根元に存在する専用のタンパク質輸送装置の模式図
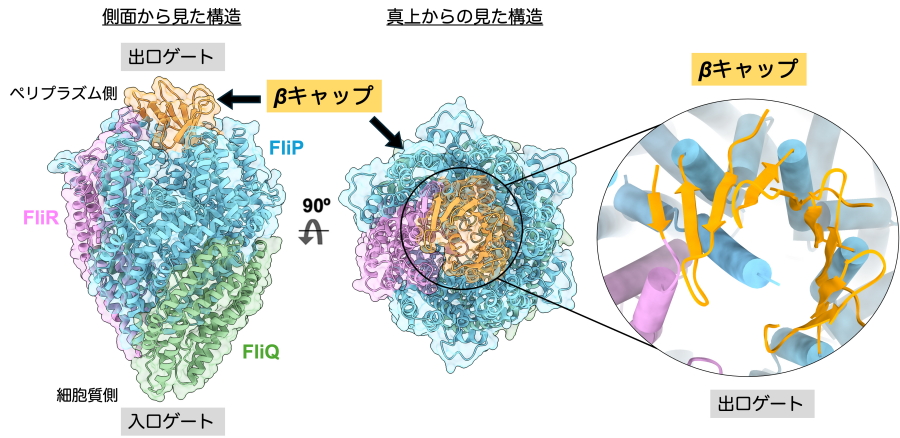
図2.ペプチディスクに再構成したFliPQR複合体の立体構造
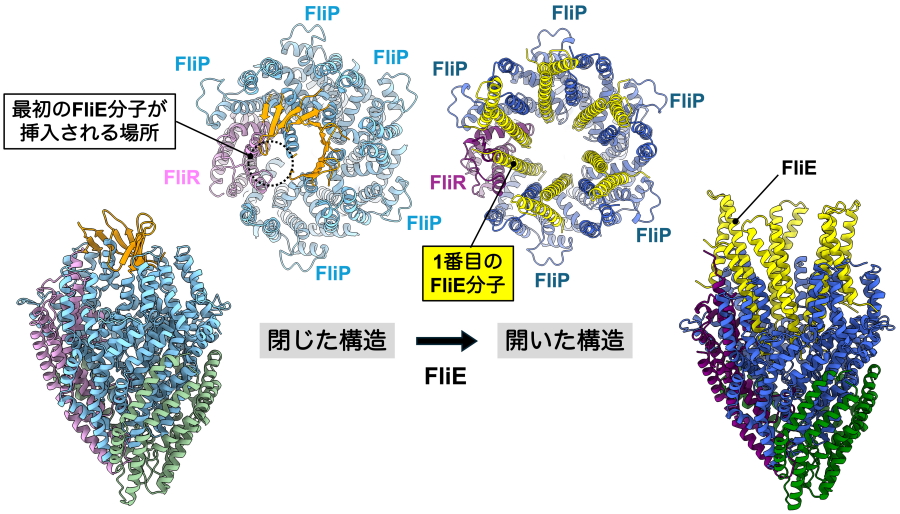
図3.FliEの結合に伴うFliPQR輸送チャネル複合体の出口ゲートの開口のしくみ
用語解説
- タンパク質輸送チャネル複合体
細胞の生体膜を貫通する膜タンパク質で、内部にはポリペプチド鎖が透過できる経路が存在する。細胞内で合成されたタンパク質が輸送チャネルを通って細胞外へ移動できる。 - タンパク質輸送装置
生体膜を透過させてタンパク質を細胞質から細胞外へと送り出す装置。 - 膜貫通型タンパク質
細胞膜などの脂質2重層に存在するタンパク質のうち、膜を貫通しているタンパク質の一般名称。膜貫通型タンパク質は、通常、膜の厚さ6 nm程度の脂質2重層を横切って存在し、物質輸送、情報伝達、エネルギー変換などの重要な役割を果たしている。 - クライオ電子顕微鏡
観察対象を液体エタンで急速凍結し、凍ったまま電子線で観察できる高性能な電子顕微鏡。タンパク質複合体やウイルスなどの生体試料を機能状態で観察でき、その立体構造を原子レベルで観察できる。 - βシート
アミノ酸が直線的につながったポリペプチド鎖の主鎖同士が水素結合で隣り合うことによって形成される、局所的かつ規則的な構造の一つであり、タンパク質の階層構造では二次構造に分類される。 - 界面活性剤
分子内で水になじみやすい部分と油になじみやすい部分を持つ物質の総称で、膜蛋白質を生体膜から抽出することができる。 - ペプチディスク
膜タンパク質を水中でも安定に保つために開発された、合成ペプチドによって作られる円盤状の構造体。生体膜の代わりとなる役割を果たし、膜タンパク質が本来の立体構造を保ったまま観察できるようにする。 - 創薬スクリーニング
数多くの低分子化合物の中から疾患の原因となる標的タンパク質に作用する候補分子を探索すること。
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 122(34):e2507221122 (2025) |
|---|---|
| 論文タイトル | A β-cap on the FliPQR protein-export channel acts as the cap for initial flagellar rod assembly |
| 著者 | Miki Kinoshita (1, 2), Tomoko Miyata (1, 2), Fumiaki Makino (1, 2, 3), Katsumi Imada (4), Keiichi Namba (1, 2), Tohru Minamino (1)
|
| PubMed | 40833400 |
