TFEBの新たな制御メカニズムを解明
種々の疾患や老化の抑制にも関わるTFEB制御の統一的な理解に貢献
| 原著論文 | J. Cell Biol. 224(10):e202307079 (2025) |
|---|---|
| 論文タイトル | ATG conjugation dependent/independent mechanisms underlie lysosomal stress induced TFEB regulation |
概要
大阪大学大学院生命機能研究科大学院生の赤山詩織さん(博士後期課程、研究当時)、大阪大学大学院医学系研究科保健学専攻の吉森保寄附講座教授、奈良県立医科大学医学部生化学講座/オートファジー・抗老化研究センターの志摩喬之助教、中村修平教授らの研究グループは、様々なストレス下で活性化されて働く転写因子TFEBの新たな活性制御機構を明らかにしました。
TFEBは細胞内分解システムとして知られるオートファジーやリソソーム機能のマスターレギュレーターとして知られており、TFEBの活性化により神経変性疾患をはじめとした種々の疾患の抑制や寿命の延伸などにつながることも報告されていることから、その活性調節機構が注目されています。
これまでTFEBは、飢餓やリソソーム損傷、ミトコンドリアストレスといった種々のストレスで活性化されることが知られていますが、これら様々なストレスに共通した、活性制御メカニズムについてはよくわかっていませんでした。
今回、研究グループは、ライブイメージング、オミックス解析などからリソソーム損傷時のTFEBの活性化にはATG結合系と呼ばれるオートファジー関連因子の一部の機能グループの働きに依存した機構と、これに依存しない機構の2つのモードがあることを発見しました(図1)。またこの2つのうちいずれかのモードがミトコンドリアストレス、DNA損傷、酸化ストレス、プロテアソーム阻害、リソソームCa2+チャネルのアゴニスト処理といった種々のストレス下のTFEB活性化で働くことを見つけました(図1)。これにより、TFEBの活性制御の統一的理解に貢献することや種々の疾患や老化の抑制へつながる可能性が期待されます。
研究の背景
TFEBは通常細胞質に存在していますが、細胞が様々なストレス(飢餓やリソソーム損傷、ミトコンドリアストレス、DNA損傷、酸化ストレス、プロテアソーム阻害など)を受けると核に移行して活性化され、オートファジーやリソソーム機能を制御する遺伝子の発現をまとめてオンにするマスターレギュレーターとして働くことが知られています。TFEBは神経変性疾患、リソソーム病、結晶性腎症、がんなどの種々の疾患や老化、さらには休眠の制御などにおいて重要な役割をもつことが知られていることから、TFEBの活性制御の仕組みが注目されていますが、特に種々のストレス下でのTFEBの活性制御機構は十分分かっていません。
研究グループでは、以前の研究でリソソームが損傷を受けた際にTFEBが活性化し、傷ついたリソソームの修復に必須であることを見出していました(Nakamura et al., Nat Cell Biol, 2020)。またこの活性化にはATG結合系による脂質化LC3の働きが必要であることを見出していました。脂質化LC3はオートファジーの際に形成されるオートファゴソームの膜に局在する因子として有名ですが、リソソームが損傷した際にはLC3はリソソーム膜に局在し、リソソームからのカルシウム流出を促すことでTFEBの核移行、活性化を引き起こすことが分かっていました。
本研究の成果
今回の研究では、ライブイメージングによりリソソーム損傷時のTFEBの挙動を詳しく観察したところ、ATG結合系が働かない細胞においても、TFEBは一度核移行、活性化し、その後、核から細胞質に戻っていく様子が認められました(図2)。このことから、リソソーム損傷時には少なくともATG結合系に依存しないTFEB活性制御と、ATG結合系に依存した制御の2種類があることが示唆されました。
そこでこれら制御をそれぞれモードI(ATG結合系非依存的制御)、モードII(ATG結合系依存的制御)と名付け、詳しく解析を進めたところ、モードI、IIで異なるTFEBのターゲットが存在することがわかりました。モードIにおいてTFEB制御に関わる新規の因子として、APEX1を同定し、この働きがTFEBの安定化を介して活性制御に働くことを見出しました(図3)。また、モードIIと関連して働く因子として、TRIP6およびCCT7因子を同定しました(図3)。これら因子はATG結合系が働かない細胞でTFEBの核移行、活性化を阻害することや野生型の細胞でもTFEB活性の終結に関与することがわかりました。
さらにリソソーム損傷以外の様々なストレス下でのTFEBの活性化機構についてATG結合系との関連を調べたところ、酸化ストレスやプロテオソーム阻害時のTFEB活性化はモードIを、ミトコンドリアストレス、DNA損傷、リソソームCa2+チャネルのアゴニスト処理時のTFEB活性化ではモードIIを介して行われていることが分かりました(図1)。
研究成果のポイント
- 様々なストレス下で活性化されて働く転写因子Transcription factor EB(TFEB)の新たな2つの活性制御機構が明らかに。
- 転写因子TFEBはオートファジーやリソソーム機能の制御を通して種々の疾患や老化抑制に働くことが知られているが、その活性制御の仕組みは十分わかっていなかった。
- リソソーム損傷時のライブイメージングなどからTFEBの活性制御にはATG結合系と呼ばれるオートファジー関連因子の一部の機能グループの働きに依存した機構と、これに依存しない機構の2つのモードがあることを発見。
- TFEBの活性制御の統一的理解への貢献及びTFEB活性を調整することで種々の疾患や老化の抑制へつながる可能性に期待。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、種々のストレス下のTFEBの活性制御が2つのモードのいずれかを介していることが明らかとなり、今後TFEB活性制御の統一的理解への貢献が見込まれます。またTFEBの活性制御の理解が進むことにより、TFEB活性を調整することで種々の疾患や老化の抑制にもつながる可能性があります。
特記事項
本研究成果は、2025年8月29日(金)23時(日本時間)に米国科学誌「Journal of Cell Biology」(オンライン)に掲載されました。
なお、本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)研究開発領域「ストレスへの応答と疾病発症に至るメカニズムの解明」における研究課題「リソソームストレス応答の破綻による神経・筋疾患発症機序の解明と超早期バイオマーカー開発」(研究代表者:中村修平)「JP24gm1910008」、研究開発領域「プロテオスタシスの理解と革新的医療の創出」における研究課題「細胞内膜動態によるプロテオスタシス制御の理解:健康長寿の実現に向けて」(研究代表者:吉森保)「JP22gm1410014」、日本学術振興会基盤研究S「疾患と老化に対抗するオートファジーの分子機構と制御因子の作動原理の解明」(研究代表者:吉森保)「22H04982」、文部科学省学術変革領域研究B「TFEB依存的・非依存的ポストリソソームシグナルによる個体および生殖寿命制御機構」(研究代表者:中村修平)「21H05145」、学術変革領域研究A「リソソーム構成タンパク質のターンオーバーを担う分子機構と老化における役割の解明」(研究代表者:中村修平)「24H01910」、日本学術振興会特別研究員奨励費「リソソーム損傷時におけるLC3依存的・非依存的な持続的TFEB活性制御機構の解明」(研究代表者:赤山詩織)「22J11895」等の支援を受けて行われました。
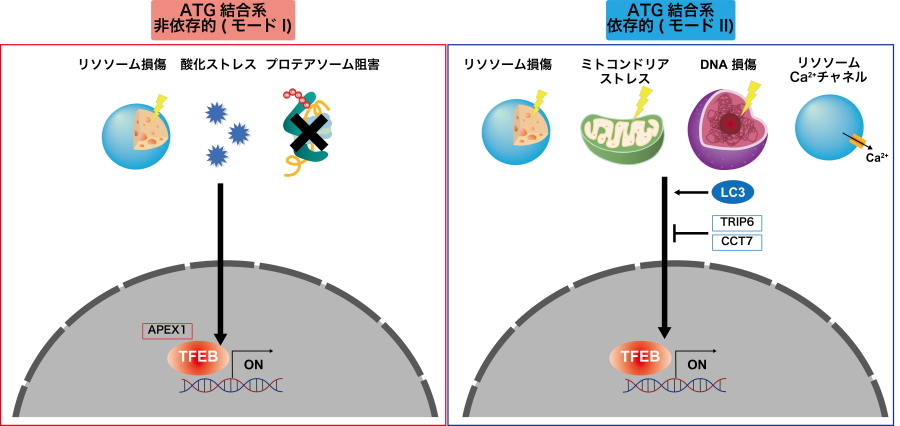
図1.研究成果概要
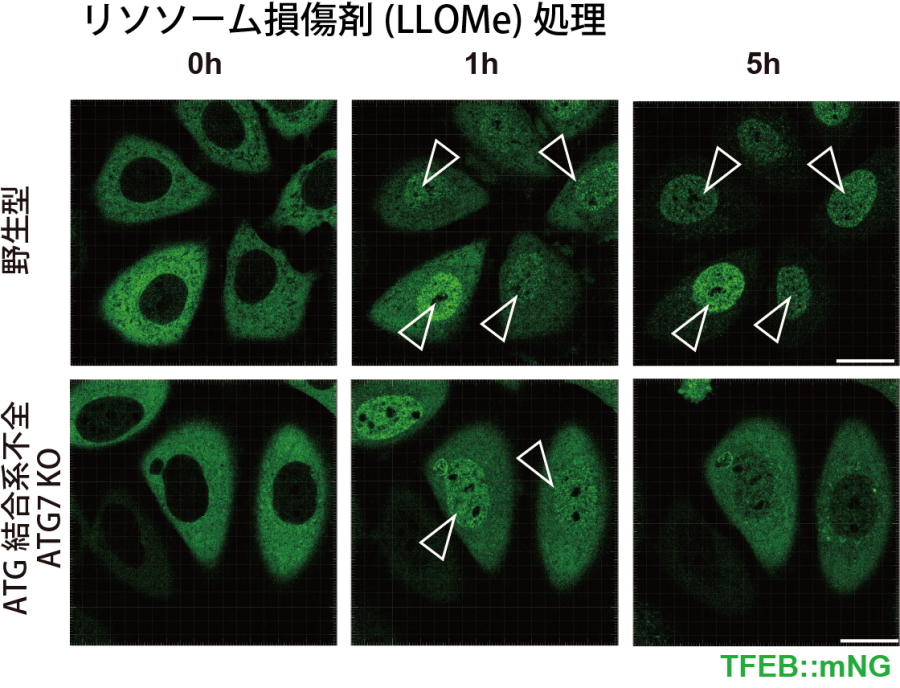
図2.リソソーム損傷時のTFEBのダイナミクス
野生型ではTFEBはリソソーム損傷により核移行、活性化(矢頭)し、これが継続する。ATG結合系が働かない細胞でもTFEBは一度核移行、活性化するが(1h)、その後細胞質へ戻っていく(5h)。
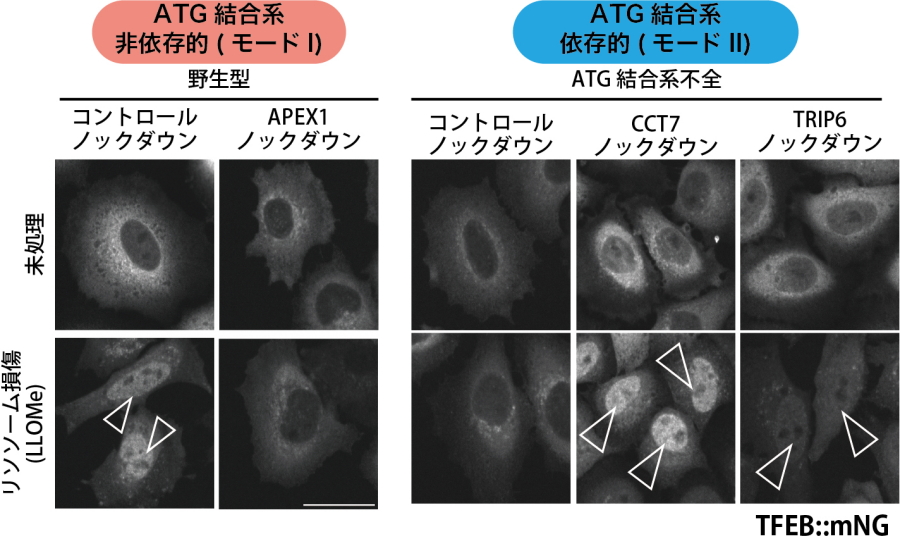
図3.リソソーム損傷時の新規TFEB制御因子
モードIで働く因子としてAPEX1を同定。ノックダウンによりTFEB核移行、活性化が低下。モードIIに関連して働く因子としてCCT7、TRIP6を同定。それぞれのノックダウンでATG結合系不全細胞でTFEBの核移行がレスキューされる。
用語解説
- Transcription factor EB(TFEB)
リソソーム生合成やオートファジーに関連したタンパク質の遺伝子発現を活性化する転写因子。 - オートファジー
細胞が持つ自己分解経路であり、栄養飢餓などにより引き起こされる。分解対象をオートファゴソームと呼ばれる脂質二重膜で隔離し、リソソームと融合させる。その後、リソソーム内の加水分解酵素により内容物を消化する。 - ATG結合系
ATG結合系は、オートファゴソーム形成に必須なユビキチン様修飾系で、ATG12–ATG5–ATG16L1複合体とLC3–PE修飾の2系統があります。ATG12はATG7とATG10を介してATG5と結合し、ATG16L1と複合体を形成して膜に局在します。LC3はATG4で切断された後、ATG7とATG3によりPEと結合し、オートファゴソーム膜に組み込まれ、cargo認識にも関与します。ATG結合系はオートファゴソームの脂質二重膜へのLC3結合に必須であるが、その非オートファジー機能としてエンドリソソームを含む一重膜にLC3を結合させることも報告されている。
| 原著論文 | J. Cell Biol. 224(10):e202307079 (2025) |
|---|---|
| 論文タイトル | ATG conjugation dependent/independent mechanisms underlie lysosomal stress induced TFEB regulation |
| 著者 | Shiori Akayama (1, 2), Takayuki Shima (2, 3), Tatsuya Kaminishi (4), Mengying Cui (4), Jlenia Monfregola (5), Kohei Nishino (6), Andrea Ballabio (5, 7, 8, 9), Hidetaka Kosako (6), Tamotsu Yoshimori (10), Shuhei Nakamura (2, 3)
|
| PubMed | 40880129 |
