DNA修復酵素Polβが神経細胞発生時の突然変異を抑制する
脳発達障害や精神疾患の起源に迫る
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 122(33):e2506846122 (2025) |
|---|---|
| 論文タイトル | DNA polymerase β suppresses somatic indels at CpG dinucleotides in developing cortical neurons |
| 研究室サイト | 心生物学研究室〈八木 健 教授〉 |
概要
大阪大学大学院生命機能研究科の菅生紀之特任准教授(常勤)と八木健教授らの研究グループは、放射線影響研究所分子生物科学部の内村有邦副部長ら、山梨大学発生工学研究センター若山照彦教授らの研究グループとの共同研究として、DNA修復酵素DNAポリメラーゼβ(Polβ)が脳形成中の神経細胞における体細胞突然変異の発生を強く抑制していることを世界で初めて明らかにしました。
私たちの脳は、発生過程で精緻に構築された遺伝子の設計図に従って形成されます。しかしこの過程で、DNAに予期せぬ傷が生じ、それが修復されないまま残ると、神経細胞に不可逆的な突然変異が蓄積することが知られていましたが、その仕組みは不明でした。
今回、Polβを欠損させたマウスの神経細胞の発生過程の全ゲノム配列解析を詳細に行いました。すると、遺伝子を活性化するDNA脱メチル化に際して、神経関連遺伝子の発現調節を担うエンハンサー領域にあるCpG配列の近傍に、インデル変異(塩基の欠失や挿入)が集中的に生じることを明らかにしました。
これにより、突然変異を原因とする脳発達障害や神経疾患の起源としての理解につながるだけでなく、DNA修復機構やエピゲノム制御を標的とした、新たな治療・予防法の基盤となる成果として期待されます。
研究の背景
DNAは、細胞の正常な機能を維持するための「設計図」であり、その配列情報は正確に保たれる必要があります。中でも神経細胞は、生涯にわたり分裂せず同じゲノムを保ち続けるため、発生初期に生じたDNAの傷や変異はそのまま蓄積され、将来的な細胞機能の異常や疾患リスクに直結する可能性があります。
実際、最近の研究では、脳の発生過程で生じた体細胞変異が、自閉スペクトラム症やてんかんなどの脳発達障害の原因となる可能性が示唆されています。しかし、これらの変異がどのように生じ、どのようなメカニズムで細胞に残るのかについては、これまでほとんど分かっていませんでした。
一方、神経細胞の分化が進む過程では、特定の遺伝子を活性化するために「DNA脱メチル化」と呼ばれる化学修飾の除去反応が盛んに起こります。この脱メチル化反応は、遺伝子発現を可能にする重要な現象ですが、同時にDNA損傷である一本鎖切断を引き起こすことから、適切に修復されなければ突然変異の温床になる可能性が近年示唆されてきました。
研究グループはこれまで、この反応経路に関わるDNA修復酵素DNAポリメラーゼβ(Polβ)の神経系における役割に長年注目し、Polβの欠損が神経細胞死や分化異常を引き起こすことを報告してきました。しかし、技術的に個々の神経細胞の全ゲノム配列を解析することは非常に困難であったため、突然変異が誘発されるかに関しては不明でした。
本研究の成果
研究グループでは、DNA修復酵素Polβの機能が欠損した発生期マウス大脳皮質を用いて、神経細胞に生じる体細胞変異の網羅的解析を行いました。特に本研究では、神経細胞核由来のクローン胚からES細胞(ntES細胞)を樹立することにより、分裂を終えた神経細胞のゲノム情報を高精度に複製・保存することに成功しました。この技術により、個々の神経細胞核に由来するゲノム配列を多数取得することが可能となり、従来困難だった微小なインデル変異や構造変異の検出と解析が実現しました。
その結果、Polβ欠損により、神経遺伝子のエンハンサー領域に存在するCpG配列(DNA脱メチル化が活発な部位)近傍で、インデル変異が通常の約9倍の頻度で生じることが明らかになりました。さらに、中規模~大規模な染色体異常に相当する構造変異も約5倍に増加しており、こうした変異により破壊された神経関連遺伝子も同定されました。
本研究は、神経発生における遺伝子活性化の過程で生じるDNA脱メチル化に伴う損傷には、Polβによる修復機構が不可欠であり、遺伝子制御に重要なゲノム領域にインデル変異や構造変異を選択的に引き起こすという、新たな体細胞変異の形成メカニズムを提示するものです。
研究成果のポイント
- DNA修復酵素Polβが、脳の発生過程において神経細胞が正しく分化するための遺伝子制御領域に起こるDNA配列の欠失や挿入(インデル変異)を抑制していることを世界で初めて発見
- 脳の発生過程で生じた細胞変異の発生メカニズムは不明だったが、神経細胞発生過程での遺伝子活性化(DNA脱メチル化)に伴う損傷がPolβによって修復されない場合に突然変異として残る
- 脳発達障害や脳疾患の起源として新たな分子基盤の解明や予防技術への応用に期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は、脳発生において不可欠な遺伝子発現制御の裏側で、DNA修復とのバランスがきわめて重要であることを明確に示したものです。自閉スペクトラム症などの脳発達障害や、こうした発生期の体細胞変異に起因している可能性がある老化や神経変性疾患の起点となっている可能性があります。DNA修復機構やエピゲノム制御を標的とした、新たな治療・予防法の基盤形成につながることが期待されます。
研究者のコメント
脳の発生・発達は一見完璧に見えて、実は細胞内では多くの「隠れた火種」が同時に管理されていることがわかってきました。今回、Polβがその一つ、脱メチル化に伴うDNA損傷の「後始末役」として代役がいない重要の役割を担っていることを明らかにできたことは、神経科学だけでなく、発がんや老化の研究にも波及効果があると期待しています。(菅生紀之)
特記事項
本研究成果は2025年8月13日に米国科学アカデミー紀要「Proceedings of the National Academy of Sciences of tne United States of America(PNAS)」(オンライン)に掲載されました。
なお、本研究は、日本学術振興会科研費(20K06854、22K11775、24K09644、24K03096、24H02061、22H05498、23H00390、24H01237、25H02501)、キャノン財団(M20-0008)の支援を受けて行われました。
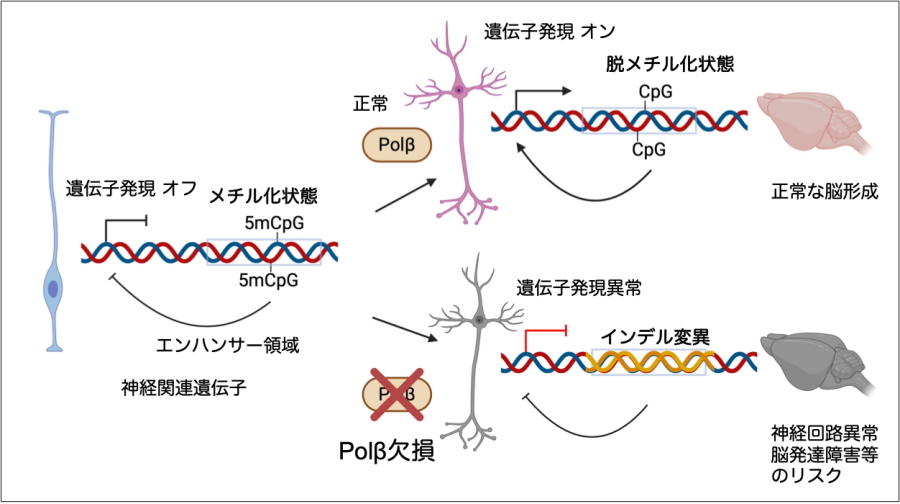
図1.神経発生に不可欠なPolβ依存的DNA脱メチル化
神経細胞の発生におけるエンハンサー領域でのDNA脱メチルに際して、Polβ欠損ではインデル変異が通常の約9倍に増加する。
用語解説
- DNA修復
DNA修復とは、紫外線、化学物質、酸化ストレス、あるいは細胞内の代謝反応などによって損傷を受けたDNAを、細胞が自ら修復する仕組みです。DNAは生命活動に欠かせない「設計図」であるため、その正確性を維持するため細胞内には複数の修復経路が備わっています。 - DNAポリメラーゼβ(Polβ)
Polβは、DNAに生じた小さな損傷を修復する「塩基除去修復(BER)」という修復経路で働く酵素です。酸化や脱アミノ化などの化学的変化によってDNAの塩基が損傷すると、細胞はBERを使ってそれを取り除き、正しい塩基に置き換えます。このとき、Polβは新たな塩基を正確に埋め込む役割を担い、ゲノムの安定性を維持するために不可欠な存在です。特に注目すべきは、Polβを含むBERが「DNA脱メチル化」に伴って生じる一時的なDNA損傷の修復にも関与している点です。 - 体細胞突然変異
体細胞突然変異とは、生まれた後の細胞分裂や外的ストレス、代謝反応などによって、体の細胞に後天的に生じるDNAの変化(突然変異)です。親から受け継いだ遺伝情報とは異なり、その個体の一部の細胞だけに存在する変異であり、細胞が分裂・分化していく過程で蓄積されることがあります。神経細胞のように一度分化すると分裂しない細胞では、発生初期に生じた体細胞突然変異がそのまま残り、神経機能や回路形成に影響を及ぼす可能性があります。 - DNA脱メチル化
DNAの塩基配列上に付加された「メチル基(-CH3)」という化学修飾を取り除く反応です。メチル基は主に「CpG配列」と呼ばれる特定のDNA配列のシトシンに修飾され、遺伝子の働きを抑える役割を担います。脱メチル化が起こることで、その遺伝子が「オン」になり、細胞が新たな機能を獲得する準備が整います。特に脳の発生過程では、神経細胞が正しく分化するためにこの脱メチル化が活発に起こります。ただしこの過程では、DNAに一時的な切れ目(DNA損傷)が生じるので、適切な修復がされないと突然変異につながるリスクがあります。 - エンハンサー領域
エンハンサーとは、遺伝子の「スイッチ」のような役割を持つゲノム領域です。たとえ遺伝子本体(コーディング領域)から離れた場所にあっても、その働きによって特定の遺伝子の発現をコントロールすることができます。脳を含む多くの組織では、時期や細胞種ごとにエンハンサーが活性化されることで、遺伝子の適切な発現が制御されています。今回の研究では、エンハンサー領域に集中して変異が生じていたことが確認されており、遺伝子の調節機構に対する新たな損傷のリスクが示唆されました。 - インデル変異
「insertion(挿入)」と「deletion(欠失)」を合わせた言葉で、DNA配列の一部が抜け落ちたり、新たに入り込んだりする小さな変化を指します。インデル変異は、数塩基程度のごく微小な変化であっても、重要な遺伝子の構造や読み取り枠(フレーム)を乱すことで、細胞機能に大きな影響を与えることがあります。今回の研究では、神経発生中にこのインデル変異が特定のゲノム領域(遺伝子制御領域)に集中して蓄積される現象が観察されました。 - エピゲノム
エピゲノムとは、DNAそのものの配列を変えることなく、遺伝子の働きを調節する「化学的な目印」のことです。代表的なものにDNAメチル化やヒストン修飾があり、これらの変化によって、ある遺伝子が「オン」になるか「オフ」になるかが決まります。特に発生過程では、細胞が適切に分化するためにエピゲノムの変化がダイナミックに起こることが知られています。 - ntES細胞
ntES細胞とは、分化を終えた細胞の「核」を用いてクローン胚を作製し、そこから得られた胚性幹細胞(ES細胞)です。この方法により、本来は分裂しない神経細胞のゲノム情報を高精度かつ大量にコピーすることが可能となります。今回の研究では、この技術を活用することで、1個の神経細胞から実験可能な量のゲノム情報が得られ、突然変異を詳細に解析することができました。 - 構造変異
構造変異とは、DNA配列の中で比較的大きな領域が欠けたり、逆向きになったり、余分に挿入されたりするような変化のことです。数百塩基以上の規模で起こることが多く、遺伝子全体が失われたり、複数の遺伝子が異常につながるなど、細胞に大きな影響を与える可能性があります。
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 122(33):e2506846122 (2025) |
|---|---|
| 論文タイトル | DNA polymerase β suppresses somatic indels at CpG dinucleotides in developing cortical neurons |
| 著者 | Noriyuki Sugo (1), Arikuni Uchimura (2), Risa Matsumoto (1), Hiro Nakayama (1), Shota Fujimoto (1), Saya Mizuno (1), Mayumi Higuchi (1), Masaaki Toshishige (2), Yasunari Satoh (2), Sayaka Wakayama (3), Teruhiko Wakayama (3), Takeshi Yagi (1)
|
| PubMed | 40802685 |
