ミトコンドリアとリソソームの恒常性維持&細胞老化を抑制する分子メカニズムの発見
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 121(2):e2306454120 (2024) |
|---|---|
| 論文タイトル | HKDC1, a target of TFEB, is essential to maintain both mitochondrial and lysosomal homeostasis, preventing cellular senescence |
| 研究室サイト | 細胞内膜動態研究室 |
概要
大阪大学大学院医学系研究科の大学院生の崔夢瑩さん(博士後期課程)、医学系研究科遺伝学/生命機能研究科細胞内膜動態研究室の吉森保教授、奈良県立医科大学医学部医学科生化学講座の中村修平教授らの研究グループは、ミトコンドリアとリソソーム両者のクオリティーコントロールを介して、細胞老化を抑制する新たな分子メカニズムを明らかにしました(図1)。
エネルギー産生を担う細胞内小器官であるミトコンドリアと、生体分子の分解を担うリソソームの機能を維持することは細胞を健康に保つうえで重要です。またミトコンドリアとリソソームは細胞内において接触部位をもちクロストークを行っており、互いの機能維持にそれぞれの存在が重要であることが示唆されています。さらに近年、細胞老化や様々な加齢関連疾患において、損傷を受けて機能低下したミトコンドリアやリソソームが共に蓄積していることが報告され、これが細胞老化や様々な加齢関連疾患における共通した特徴であることがわかってきました。しかし、ミトコンドリア、リソソームを制御する共通の機構があるのかどうか、両者のクロストークの分子機構、またその老化における意義は不明でした。
今回、研究グループは、オートファジー・リソソーム機能のマスター転写因子として働き、ミトコンドリア機能制御にも関わる転写因子TFEBに着目し、この下流でミトコンドリアおよびリソソーム両者のクオリティコントロールに関わる共通因子を探索しました。その結果、ミトコンドリアとリソソームが損傷を受けた際にTFEB依存的に活性化される新規の因子として、ヘキソキナーゼファミリーの一つHKDC1を同定しました。HKDC1は解糖系の酵素として働くことが知られていますが、この機能とは独立して、損傷したミトコンドリアの除去や損傷リソソームの修復を介して両者のクオリティーコントロールに必須の働きを持つことが分かりました。HKDC1はミトコンドリア損傷時において代表的な損傷ミトコンドリア除去機構であるPINK1/Parkin依存性マイトファジーを介して損傷ミトコンドリアの除去を担うこと、またリソソーム損傷時においては、ミトコンドリア・リソソーム接触部位を増加させ、リソソームの膜修復を促進していることを見出しました。さらにHKDC1を欠損した細胞では機能低下したミトコンドリアや損傷リソソームの蓄積を伴い、細胞老化が進行することが分かりました。これらの結果から、TFEBの下流でHKDC1はミトコンドリアとリソソーム両者の恒常性を維持し、細胞老化の抑制に働く必須の因子であることが明らかとなりました。今後TFEB-HKDC1経路の調節を介した老化抑制や加齢性疾患の治療法への応用に役立つことが期待されます。
研究の背景
エネルギー産生を担う細胞内小器官であるミトコンドリアと、生体分子の分解を担うリソソームはどちらも細胞を健康に保つうえで重要な細胞内小器官です。またミトコンドリアとリソソームは接触部位をもち、脂質やアミノ酸など代謝物の移動、イオンの交換を行うことにより互いの機能維持に重要な役割を果たします。実際ミトコンドリア病ではリソソーム機能不全が、またリソソーム病ではミトコンドリアの機能不全が生じることからもミトコンドリアとリソソームとの密接な関わり合いは明らかです。さらに近年細胞老化や様々な加齢関連疾患において損傷ミトコンドリア・損傷リソソームが蓄積していることが明らかとなり、ミトコンドリアやリソソームの機能不全は細胞老化や様々な加齢関連疾患における共通した特徴であることがわかってきました。
損傷ミトコンドリアの除去機構には複数の経路が知られていますが、代表的な機構としてPINK1/Parkin依存性マイトファジー(オートファジーによる損傷ミトコンドリアの除去)が挙げられます。この機構においては、ミトコンドリアのストレスがミトコンドリア脱分極を引き起こし、PINK1が安定化し活性化します。この活性化PINK1はリン酸化応答によりマイトファジーに重要なユビキチン化酵素であるParkinが損傷ミトコンドリア上へ移行するのを促進し、Parkinはミトコンドリアタンパクをユビキチン化することによりマイトファジーが進行します。またリソソームが損傷した際には、損傷リソソームの修復機構、リソファジー(オートファジーによる損傷リソソームの除去)、リソソーム生合成機構など、複数の機構によりリソソーム恒常性が維持されます。
本研究グループをはじめとした研究により、転写因子TFEBはミトコンドリア損傷時とリソソーム損傷時のいずれにおいても活性化され、損傷ミトコンドリアや損傷リソソームの除去・修復に関わることが明らかとなっています(Nakamura et al., Nat Cell Biol, 2020;Nezich et al., J Cell Biol, 2015)。またTFEBは細胞老化や個体老化の制御にも密接に関与することが知られています(Lapierre et a., Nat Commun, 2013;Curnock et al., EMBO J, 2023)。しかしTFEBの下流でミトコンドリア、リソソームの恒常性を制御する共通の機構があるのか、またそうであればその細胞や個体老化での意義は何なのか、よく分かっていませんでした。
本研究の成果
研究グループはまず、ミトコンドリアとリソソームがストレスを受けた際の遺伝子発現変化をRNA-seq によって解析し、いずれのストレスでもTFEB依存的に発現上昇する共通の標的遺伝子としてHKDC1を同定しました(図2上)。ChIP(クロマチン免疫沈降)とこれに続くqPCR(定量PCR)解析から、TFEBはHKDC1遺伝子の上流約3000bpにあるプロモーター領域に結合し、転写を直接活性化することが明らかとなりました(図2下)。
次に損傷ミトコンドリア応答として代表的なマイトファジーとHKDC1との関わり合いを検証しました。マイトファジーを誘導するミトコンドリア脱分極剤存在下において、HKDC1ノックダウン細胞ではミトコンドリアタンパクの分解が阻害されており、HKDC1がマイトファジーに必須の働きをもつことが明らかとなりました(図3上)。次に代表的なマイトファジー経路であるPINK1/Parkin依存性マイトファジーにおけるHKDC1の役割を検証したところ、HKDC1はPINK1/Parkin依存性マイトファジーの最初のステップであるPINK1の安定化に不可欠であることが明らかとなりました(図3下)。さらにプロテオミクス解析により、HKDC1はTOM70と相互作用することが明らかとなり、これによりPINK1の安定化を制御していることが分かりました。(図3下)
次に、損傷リソソーム時におけるHKDC1の果たす役割を検証したところ、HKDC1欠損細胞においてはリ損傷リソソームの修復が十分に行われないことがわかりました(図4上)。研究グループはミトコンドリアタンパクであるHKDC1が損傷リソソームの修復を行う機構として、さまざまな物質の交換を介して互いの機能維持に必須の働きを果たすと考えられるミトコンドリア-リソソーム接触部位の関与を検証しました。スプリットGFPベースのセンサーを用いてミトコンドリア・リソソーム接触部位を検出したところ、野生型細胞ではリソソーム損傷時においてミトコンドリア・リソソーム接触部位が増加する一方で、HKDC1ノックダウン細胞では接触部位の増加を認めませんでした(図4下)。以上よりリソソーム損傷時HKDC1はミトコンドリア-リソソーム接触部位を増加させることで、損傷リソソームの修復に重要な役割を果たすことが明らかとなりました。 重要なことに、ドキソルビシンにより細胞老化を誘導した際にHKDC1ノックダウン細胞では損傷ミトコンドリアと損傷リソソームの蓄積を認め、細胞老化も進行していました(図5)。
以上よりTFEBが直接転写を制御するHKDC1がミトコンドリアとリソソーム両者の恒常性維持に必須の役割を持ち、損傷ミトコンドリア・損傷リソソームの蓄積を抑制し、細胞老化を防ぐことが明らかとなりました。
研究成果のポイント
- リソソームの機能を制御するマスター転写因子TFEB(Transcription Factor EB)はミトコンドリアの機能制御にも関わることが分かっていたが、TFEB下流で、この二つの細胞小器官のクオリティーコントロールに関わる共通因子があるのかは不明であった。
- 今回TFEBがミトコンドリアおよびリソソームにストレスを受けた際にヘキソキナーゼファミリーのひとつHKDC1(hexokinase domain containing 1)の発現を直接制御することにより両者のクオリティーコントロールに必須の働きを持つことを発見した。
- HKDC1は傷ついたミトコンドリアのオートファジーによる除去(マイトファジー)と同時に傷ついたリソソームの修復を促進することにより、細胞を健康に保ち細胞老化を抑制することが明らかになった。
- TFEB-HKDC1経路の調節を介した老化抑制や加齢性疾患の治療法への応用が期待される。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、ミトコンドリアとリソソーム両者のクオリティーコントロールを介して、細胞老化を制御する新たな仕組みを解明することができました。本研究で得られた知見が、健康寿命の延伸や加齢性疾患の新たな治療戦略に繋がることが期待されます。
特記事項
本研究成果は、2024年1月4日(木)(日本時間)に国際科学誌「Proceedings of the National Academy of Sciences of the United States of America」(オンライン)に公開されました。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST研究領域「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」における研究課題「オートファジーによる細胞外微粒子応答と形成」(研究代表者:吉森保)「JPMJCR17H6」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)研究開発領域「プロテオスタシスの理解と革新的医療の創出」における研究課題「細胞内膜動態によるプロテオスタシス制御の理解:健康長寿の実現に向けて」(研究代表者:吉森保)「JP22gm1410014」、日本学術振興会基盤研究S「疾患と老化に対抗するオートファジーの分子機構と制御因子の作動原理の解明」(研究代表者:吉森保)「22H04982」文部科学省学術変革領域研究B「TFEB依存的・非依存的ポストリソソームシグナルによる個体および生殖寿命制御機構」(研究代表者:中村修平)「21H05145」、日本学術振興会科研費挑戦的研究(萌芽)、「「ミクロ」オートファジーによるリソソーム膜修復を介した老化抑制機構の解明」(研究代表者:中村修平)「23K18140」の一環として行われました。
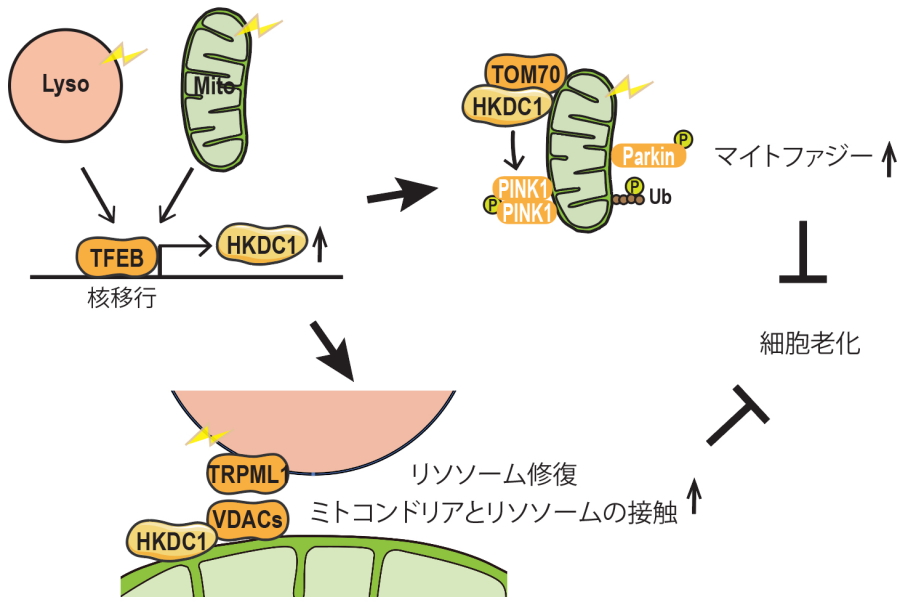
図1.研究成果の概略
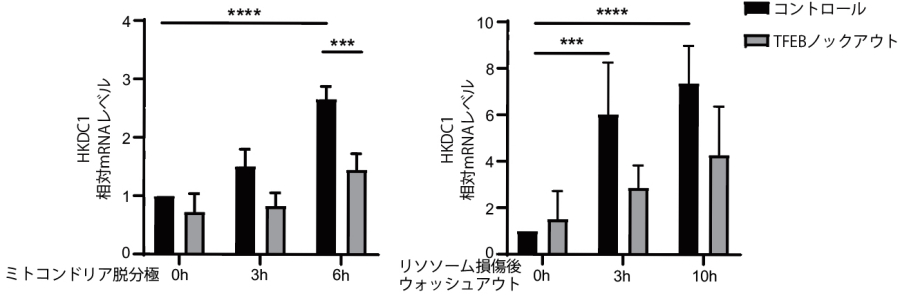
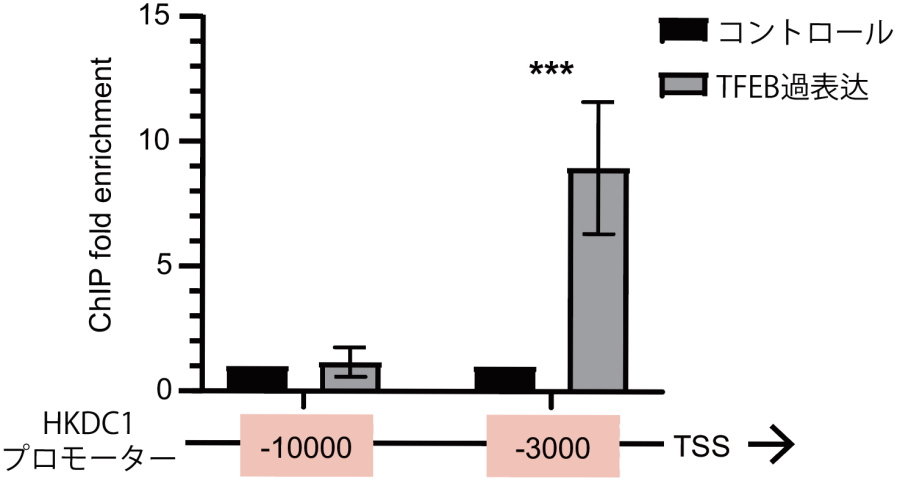
図2.HKDC1はミトコンドリア、リソソームへのストレス下におけるTFEBの直接の標的遺伝子である
(上)HKDC1はミトコンドリアおよびリソソームへのストレスによりTFEB依存的に発現上昇する。(下)ChIP-qPCR実験。TFEBはHKDC1のプロモーター領域に結合する。
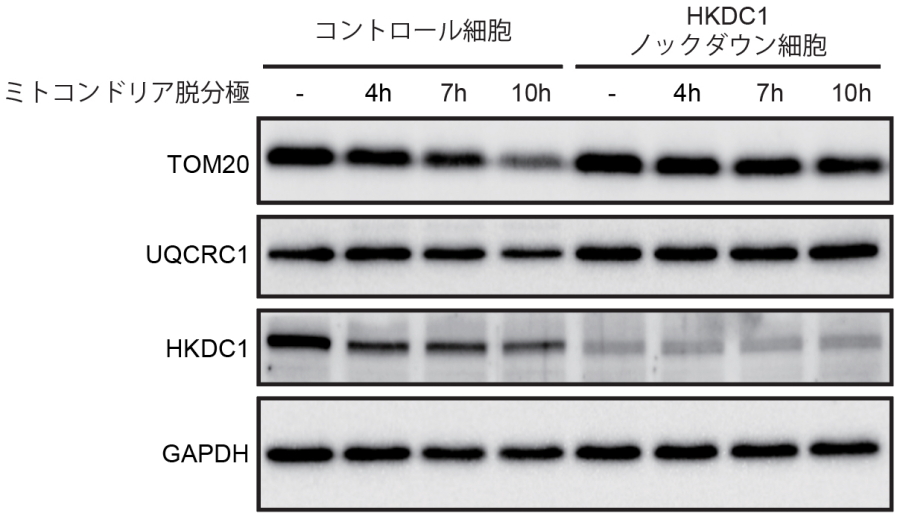
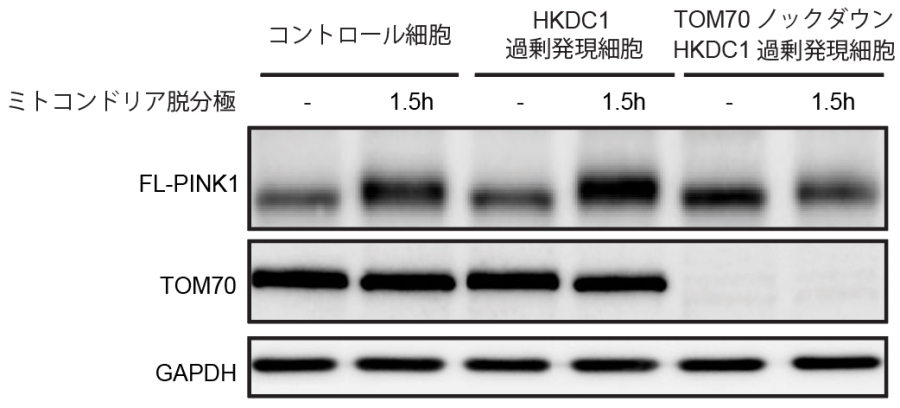
図3.HKDC1はPINK1の安定化を介してPINK1/Parkin依存マイトファジーに必須の働きをもつ
(上)ミトコンドリア脱分極時、コントロール細胞ではミトコンドリアタンパク質TOM20およびUQCRC1が徐々に分解される。一方、HKDC1ノックダウン細胞ではこの分解が抑制される。(下)ミトコンドリア脱分極時、コントロールの細胞ではPINK1の蓄積が見られる。HKDC1を過剰発現するとこの蓄積がTOM70依存性に亢進(こうしん)する。
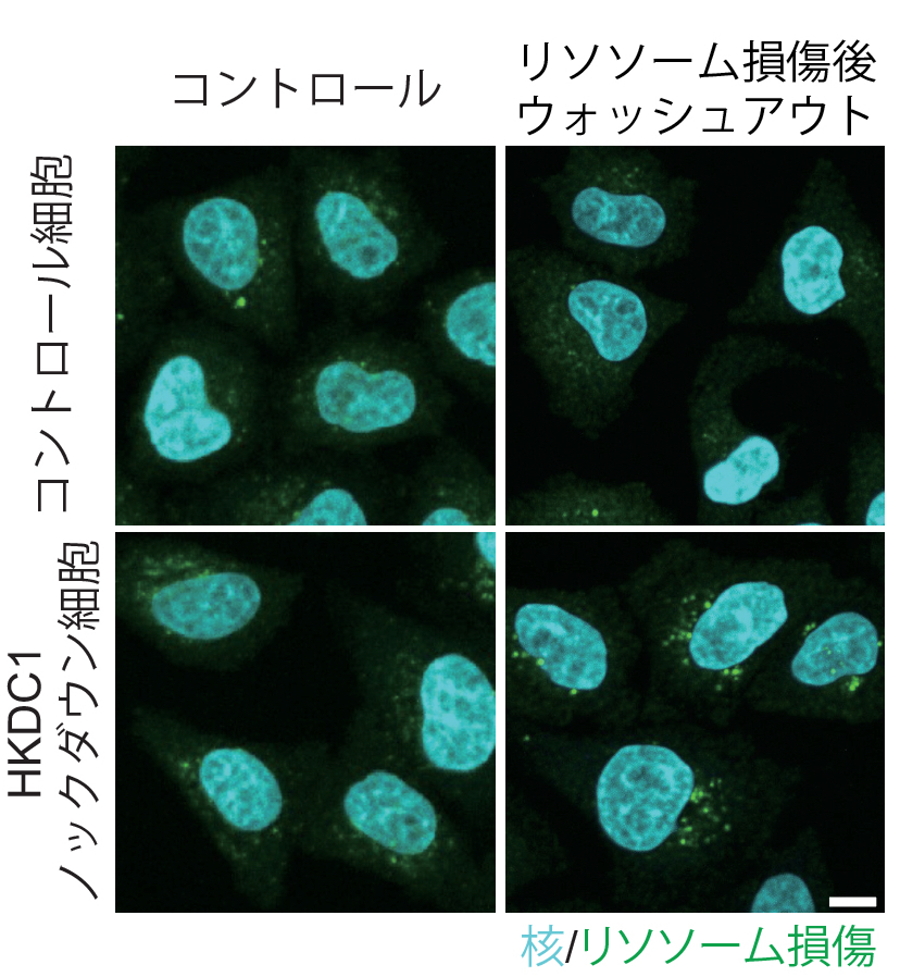
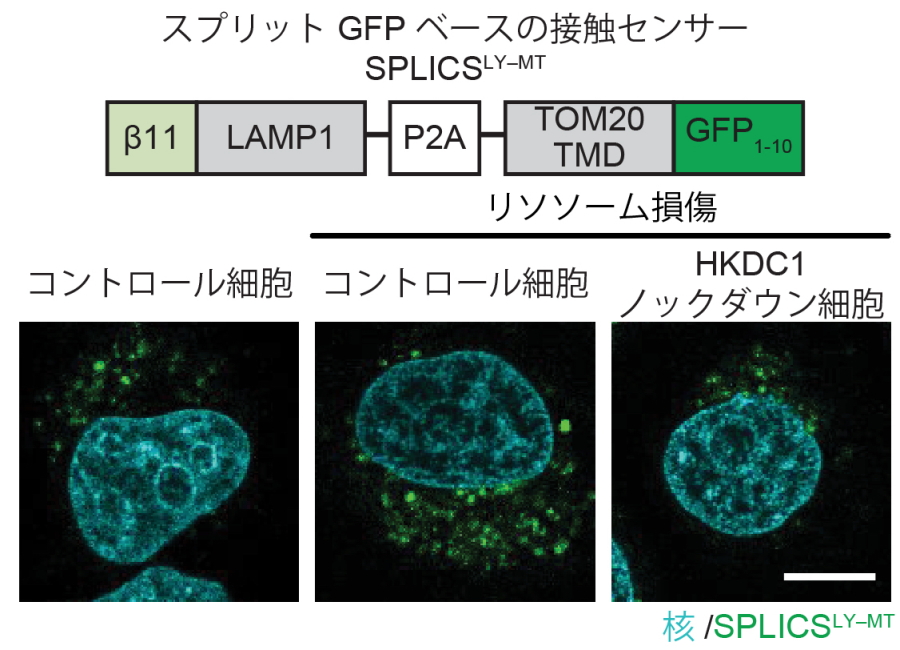
図4.HKDC1の欠損によりリソソーム損傷が亢進する
(上)リソソーム損傷後、コントロール細胞ではリソソーム損傷が回復する。一方でHKDC1ノックダウン細胞ではリソソーム損傷細胞の著明な残存を認める。(下)リソソーム損傷時、ミトコンドリア・リソソーム接触部位が増加するが、HKDC1ノックダウン細胞では接触部位の増加は認めない。
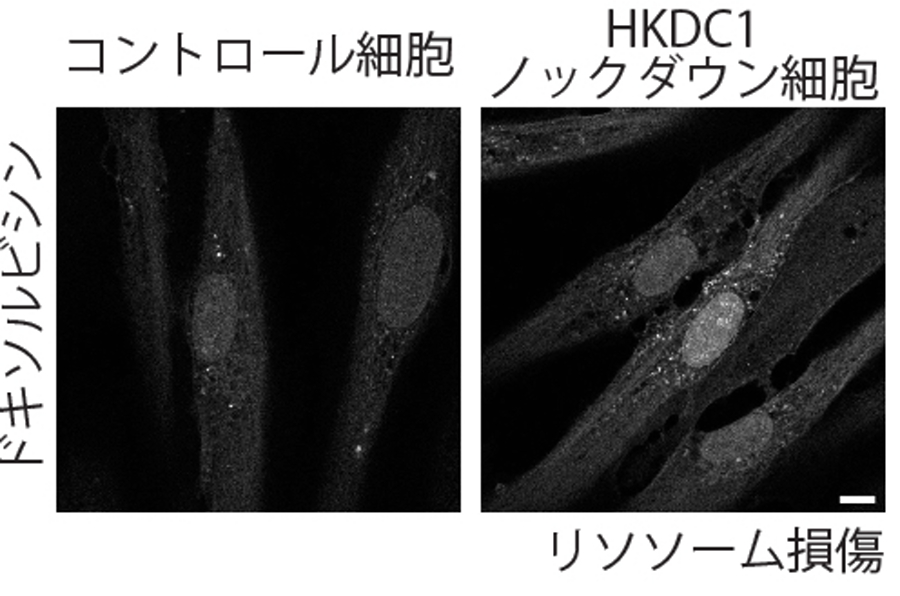
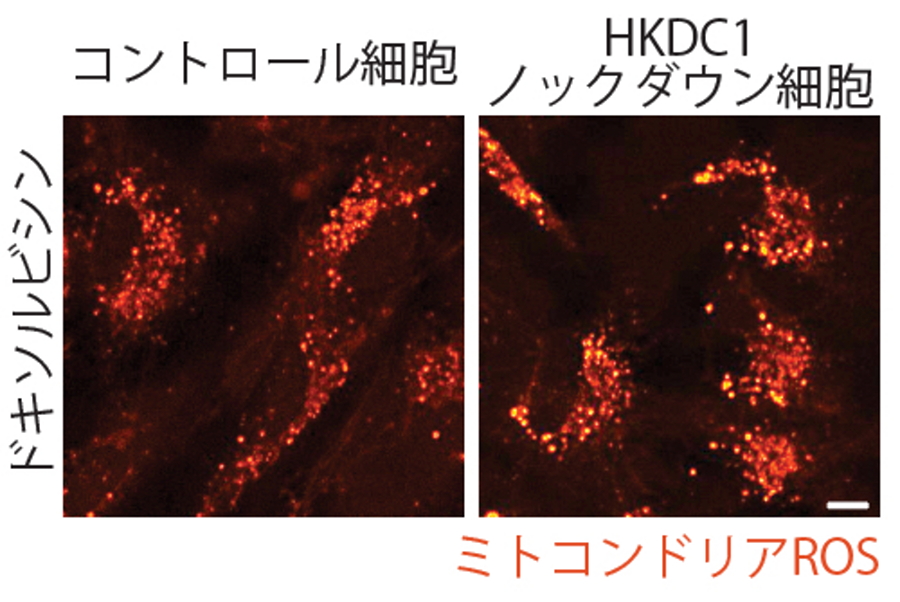
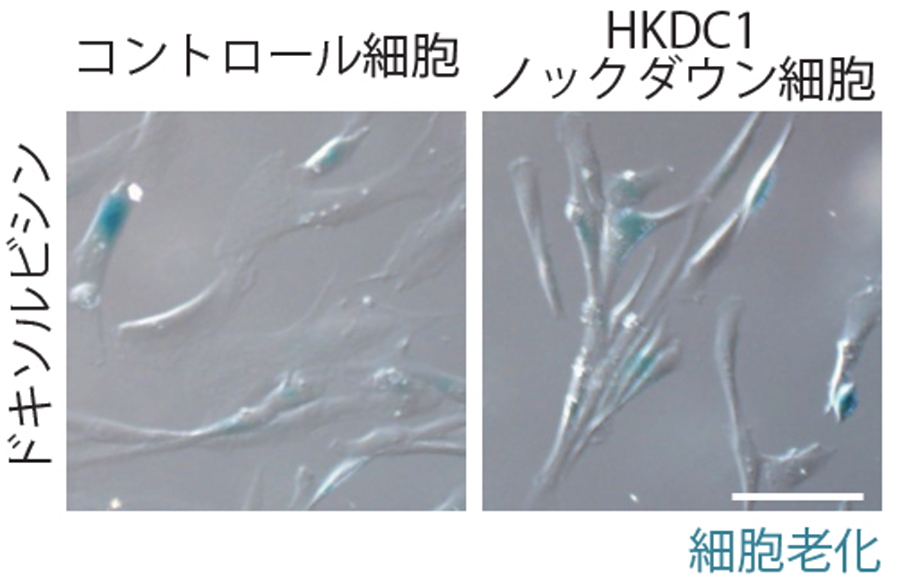
図5.HKDC1の欠損により細胞老化が進行する
野生型細胞とHKDC1ノックダウン細胞にドキソルビシンによる細胞老化の誘導を行った。HKDC1ノックダウン細胞ではミトコンドリアROS(活性酸素)の増加(上)、損傷リソソームの蓄積(中)、細胞老化の進行(下)を認める。
用語解説
- 細胞老化
増殖中の正常な細胞に、がん遺伝子の活性化や酸化的ストレス等が加わり、修復不可能なほど強いDNA損傷が起こった際に誘導される不可逆的細胞増殖停止現象。 - マイトファジー
オートファジーを介したミトコンドリアの選択的分解機構であり、損傷したミトコンドリアの代謝に関与しているとされる。 - ミトコンドリアの脱分極
二重膜構造のミトコンドリアの内膜に配置する,ATP産生などを司る呼吸鎖複合体は,その代謝活性により内膜を境にH+イオン濃度勾配による電位差(ミトコンドリア膜電位)を形成する。膜電位が保たれることはミトコンドリアの活性が維持されていることの指標となり,種々の要因によりこの膜電位を消失させると(脱分極)、ミトコンドリアは膜構造が断片化され機能不全となる。 - RNA-seq
次世代シーケンスを用いて取得したリードの情報(生データ)をデータ解析することにより、遺伝子の発現量が解析できる手法。 - プロテオミクス解析
ゲノミクスに対する言葉。従来の個別のタンパクの解析とは違い,いつどこでどのタンパクがどれだけ発現しているかを系統的、網羅的にデータ収集し解析する技術、方法論。
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 121(2):e2306454120 (2024) |
|---|---|
| 論文タイトル | HKDC1, a target of TFEB, is essential to maintain both mitochondrial and lysosomal homeostasis, preventing cellular senescence |
| 著者 | Mengying Cui (1), Koji Yamano (2, 3), Kenichi Yamamoto (4, 5), Hitomi Yamamoto-Imoto (1), Satoshi Minami (1, 6), Takeshi Yamamoto (6), Sho Matsui (6), Tatsuya Kaminishi (1, 7), Takayuki Shima (8), Monami Ogura (9), Megumi Tsuchiya (10), Kohei Nishino (11), Brian T Layden (12, 13), Hisakazu Kato (14), Hidesato Ogawa (10), Shinya Oki (15), Yukinori Okada (4, 7, 16), Yoshitaka Isaka (6), Hidetaka Kosako (11), Noriyuki Matsuda (2, 3), Tamotsu Yoshimori (1, 7, 9), Shuhei Nakamura (8)
|
| PubMed | 38170752 |
