神経細胞でのクラスター型プロトカドヘリンのホモフィリック相互作用を可視化
自閉症や統合失調症の理解促進へ
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 120(38):e2301003120. (2023) |
|---|---|
| 論文タイトル | Visualization of trans homophilic interaction of clustered protocadherin in neurons |
| 研究室サイト | 心生物学研究室〈八木 健 教授〉 |
概要
大阪大学大学院生命機能研究科心生物学研究室の星野七海特任研究員(研究当時。現在Tulane大学研究員)および八木健教授らの研究グループは、大阪大学産業科学研究所生体分子機能科学研究分野の京卓志特任研究員(常勤)(JSTさきがけ専任研究者)および永井健治教授らの研究グループ、国立研究開発法人国立精神・神経医療研究センターの井上高良室長らの研究グループ、北海道大学医学研究院生理系部門解剖学分野の渡辺雅彦教授の研究グループとの共同研究により、神経細胞に特異的に発現する膜タンパク質、クラスター型プロトカドヘリン(Pcdh)のホモフィリック相互作用を神経細胞において可視化しました(図1)。
これまでPcdhがホモフィリック相互作用することは株化培養細胞の凝集観察や、タンパク質の生物物理学的測定によって明らかになっていましたが、Pcdhが本来発現する神経細胞において、いつ・どこでホモフィリック相互作用をしているのか知る方法はありませんでした。
今回、八木教授らの研究グループは、FRETを利用したプローブを作製することで、Pcdhが相互作用している様子を神経細胞でリアルタイムに観察しました。これにより、Pcdhホモフィリック相互作用の動態を解明し、シナプスでは稀にしかPcdhがホモフィリック相互作用しないということを明らかにしました。
Pcdhは自閉症や統合失調症等の疾患に関連することが指摘されており、Pcdhホモフィリック相互作用の機能解明によりこれら疾患を理解することに繋がる可能性が開けました。
研究の背景
Pcdhはマウスにおいて58種類のアイソフォームを持つ1回膜貫通型タンパク質群です。Pcdhは脳・神経系に発現することが知られていますが、個々の細胞で58種類すべてが発現しているわけではなく、およそ15種類ほどが確率的に選択されて発現していることが知られています。このことから、Pcdhはその発現アイソフォームの組み合わせにより、神経細胞に個性を与えると考えられ、注目されてきました。
さらにPcdhは、細胞膜間で相互作用する際には同一アイソフォーム同士のみが相互作用する、ホモフィリック相互作用を示すことが示唆されていましたが、実際に神経細胞でどのような時期・どのような場所にホモフィリック相互作用が起こるのかは未解明でした。
これまでに研究グループは、58種類あるPcdhのアイソフォームの1種、γB2アイソフォームにCFPもしくはYFPの2種類の蛍光タンパク質を挿入したFRETプローブを開発し、株化培養細胞におけるPcdh相互作用の可視化に成功していました。しかしながらプローブの発現量が低く、自家蛍光の強い神経細胞で観察するにはシグナル/ノイズ比が良くなく、Pcdhが本来発現する神経細胞におけるホモフィリック相互作用の動態は、依然として大きな謎のままとなっていました。また、Pcdhは神経細胞においてシナプスに局在していることが先行研究から明らかにされてきましたが、そのシナプスにおいてPcdhのホモフィリック相互作用が関係するのかは未解明でした。
本研究の成果
八木教授らの研究グループでは、separated typeと呼んでいる、FRETによりPcdhのγB2アイソフォームのホモフィリック相互作用を可視化するプローブを既に報告していました(図1)。FRETはCFPを励起した際に観察されるCFPとYFPの蛍光強度の比により測定します。この際、ある箇所に局在するCFPとYFPの分子数が異なると、CFPの励起レーザーがYFPを直接励起してしまう影響などから、CFPとYFPの蛍光強度の違いがFRETによるものなのか判別が難しくなります。
そこで本研究において、combined typeと呼ぶプローブを新たに開発しました(図1)。これはCFPが融合したPcdhγB2とYFPが融合したPcdhγB2を用意するのではなく、1つのPcdhγB2タンパク質分子にCFPとYFPの両方が融合されています。これにより、細胞内の任意の場所で常にCFPとYFPが同数局在することが期待され、観察されるCFPとYFPの蛍光強度変化におけるFRETの寄与を相対的に高めることができました。このような、一つのタンパク質分子にCFPとYFPの両方を融合し、分子間FRETを起こすプローブをDENIM(Direct Excitation auto-Normalizing InterMolecular)FRET probe(直接励起自動正規化分子間FRETプローブ)と名付け、FRET観察を容易にするコンセプトとして報告しました。 この新たなFRETプローブにより、自家蛍光が強く、FRETプローブの発現量・局在量も少ない神経細胞において、初めてPcdhγB2のホモフィリック相互作用可視化に成功しました(図2)。この結果、培養神経細胞においてPcdhγB2がホモフィリック相互作用していると神経線維で静止すること、培養日数が増えるにつれてホモフィリック相互作用がより高頻度で見られることが観察されました。
さらに、このホモフィリック相互作用とシナプスを同時に観察することで、シナプスにあるPcdhγB2はほとんどホモフィリック相互作用をしていないこと、またシナプスにあるPcdhγB2は比較的大きな点として局在していることを明らかにしました。
研究成果のポイント
- 新規プローブの作製により、神経細胞でのPcdhホモフィリック相互作用の可視化に成功
- 神経細胞でのPcdhホモフィリック相互作用観察はシグナル/ノイズ比が低く困難であったが、1つのタンパク質分子に2種類の蛍光タンパク質を融合させた新たなコンセプトのFRETプローブにより解決
- 自閉症や統合失調症の理解促進に期待
本研究成果が社会に与える影響(本研究成果の意義)
Pcdhホモフィリック相互作用の機能を研究することはこれまで困難でしたが、今回作製したFRETプローブにより神経細胞のどこで・いつホモフィリック相互作用が起きているかを観察することが可能になります。Pcdhの遺伝子変異は自閉症や統合失調症に関連することも知られていることから、これらの疾患を理解する手助けとなる可能性も開けました。
研究者のコメント
クラスター型プロトカドヘリンは50種類の遺伝子からなる遺伝子群であり、神経細胞に個性を与え回路形成に関わること、ヒト精神神経疾患に関わることが知られています。同じ種類のタンパク質同士が結合する性質を持っていますが、この生理学的意義については不明でした。本論文により、神経細胞における結合活性を捉えることに成功し、脳における神経細胞の個性がつくる複雑な神経回路形成へのアプローチが可能になりました。(八木健)
特記事項
本研究成果は、2023年9月12日(火)(日本時間)に米国科学誌「Proceedings of the National Academy of Sciences(PNAS)」(オンライン)に掲載されました。
なお、本研究は、JST戦略的研究推進事業さきがけ「多細胞システムにおける細胞間相互作用とそのダイナミクス(JPMJPR2045)」、科研費先端バイオイメージング支援プラットフォーム(JP16H06280)、同全身臓器の生理的・病理的免疫状態遷移の脳による検出機構(20H05899)、同記憶をコードするセルアセンブリ形成メカニズム(18H04016)、同脳の細胞社会ダイバーシティーをもたらす複雑な神経ネットワーク形成メカニズム(20H05035)、同神経細胞の個性センサスによるセルアセンブリの構築と遷移(22H05498)、NIH Epigenomic Regulation of a Large, Neuron-specific Chromatin Domain(MH117790)の助成を受けたものです。
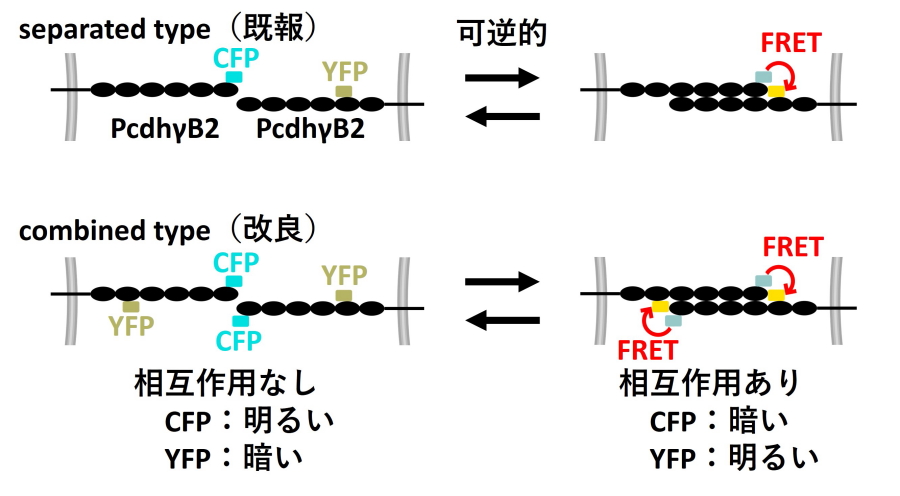
図1.
PcdhのγB2アイソフォームにCFP(水色)およびYFP(黄色)の蛍光タンパク質を融合したFRETプローブ。
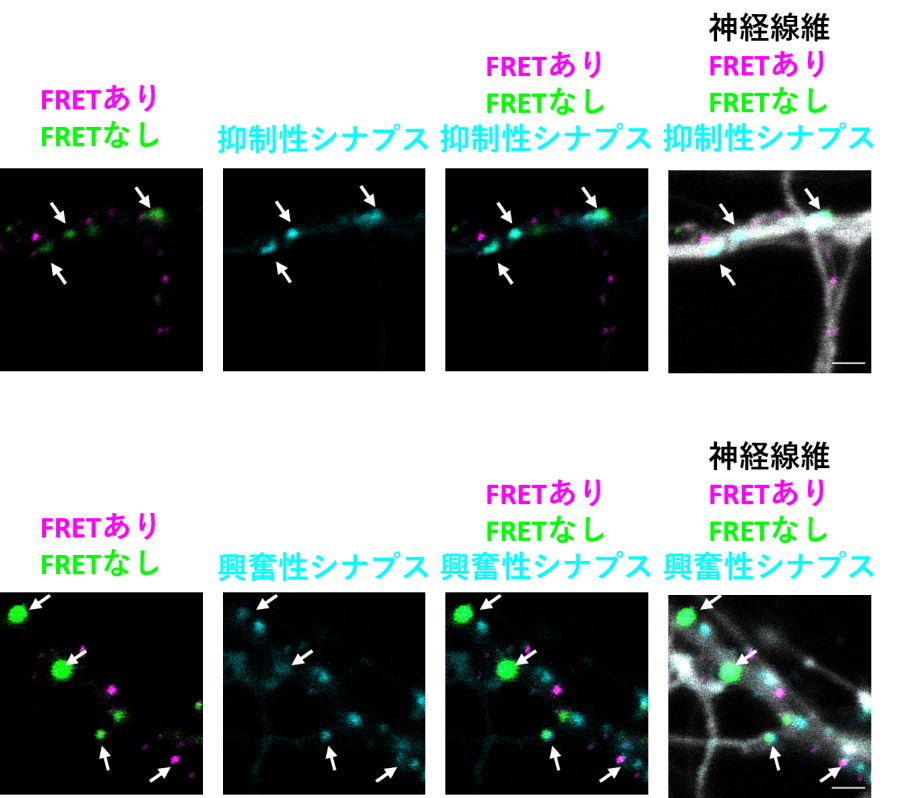
図2.
ホモフィリック相互作用しているPcdhγB2(紫色)、ホモフィリック相互作用していないPcdhγB2(緑色)と共に、抑制性シナプス(Gephryin)(水色)もしくは興奮性シナプス(PSD95)(水色)を同時に観察した。抑制性シナプスおよび興奮性シナプスにあるPcdhγB2は、稀にしかホモフィリック相互作用していないことが明らかになった。
用語解説
- ホモフィリック相互作用
同じタンパク質同士の相互作用を指す。マウスにおいてPcdhは58種類のアイソフォームから構成されるが、同じアイソフォーム同士しか細胞膜間で相互作用しないことが知られている。対義語はヘテロフィリック相互作用であり、これは異なるタンパク質間の相互作用を指す。 - FRET
ある蛍光物質Aを励起した際、そのエネルギーが別の蛍光物質Bへと移動し、結果的にBの蛍光が観察される現象。この現象はAとBが数nm以内に存在する場合にのみ観察され、タンパク質の大きさも数nm程度である。研究対象のタンパク質にAとBを適切に融合することで、タンパク質が相互作用した時にのみAとBが近づいてFRETが観察されるという状況を作ることができる。本研究においては、CFPを励起した際にYFPにどれだけエネルギーが移動するかを観察することでPcdhのγB2アイソフォームが相互作用している様子を可視化できる。
| 原著論文 | Proc. Natl. Acad. Sci. U. S. A. 120(38):e2301003120. (2023) |
|---|---|
| 論文タイトル | Visualization of trans homophilic interaction of clustered protocadherin in neurons |
| 著者 | Natsumi Hoshino (1), Takashi Kanadome (2, 3), Tomomi Takasugi (1), Mizuho Itoh (1), Ryosuke Kaneko (1), Yukiko U Inoue (4), Takayoshi Inoue (4), Takahiro Hirabayashi (1, 5), Masahiko Watanabe (6), Tomoki Matsuda (2), Takeharu Nagai (2), Etsuko Tarusawa (1), Takeshi Yagi (1)
|
| PubMed | 37695902 |
