小脳の神経細胞に巨大ラメラ体が形成される疾患モデルマウスの作製に成功
| 原著論文 | Acta Neuropathol. Commun. 10(1):172 (2022) |
|---|---|
| 論文タイトル | CTCF loss induces giant lamellar bodies in Purkinje cell dendrites |
| 研究室サイト | 心生物学研究室〈八木 健 教授〉 |
概要
徳島大学大学院医歯薬学研究部機能解剖学分野の平山晃斉准教授は、大阪大学大学院生命機能研究科の八木健教授らとの共同研究により、運動調節機能に重要な小脳のプルキンエ細胞で、幾重にも重なった膜で構成された巨大ラメラ体と呼ばれる構造が形成されるマウスの作製に成功しました。マウスは、進行性の運動失調を伴うことがわかりました。
巨大ラメラ体は、およそ40年前にウェルドニッヒ・ホフマン病の小脳プルキンエ細胞で報告されて以来、13q欠失症候群、クラッベ病で報告され、神経変性疾患との関連が示唆されてきました。しかし、その存在は剖検後の症例報告にとどまり、報告数も極めて少なく研究は進んでいません。本研究は、高次染色体構造の形成に関与して遺伝子発現を制御するCCCTC結合タンパク質(CTCF)を小脳プルキンエ細胞で欠損させたマウスにおいて、プルキンエ細胞の樹状突起に巨大ラメラ体が再現性よく形成されることを明らかとしました。解析の結果、巨大ラメラ体は小脳プルキンエ細胞の樹状突起に小胞体が層状に集積することで徐々に形成され、時間とともに巨大化していくことがわかりました。一方で細胞核周辺の小胞体は著しく減少し、最終的にはプルキンエ細胞が小脳から消失しました。また、これに伴いCTCF欠損マウスには、より重篤な運動機能の低下がみられました。
本研究の結果は、CTCFが小脳プルキンエ細胞の正常な発達と維持に重要な役割を果たすことを示しました。本モデルマウスの確立は、希少な疾患への実験的アプローチを可能とし、神経変性疾患における巨大ラメラ体形成の分子機構解明へ大きな糸口となることが期待されます。
研究の背景
CTCFはDNAに結合するタンパク質で、DNAに結合したCTCF同士がさらに結合することで染色体のループ構造形成に働きます。こうして形成された染色体の3次元的な立体配置は、遺伝子の発現制御に大きく影響します。これまでに、CTCF遺伝子領域に変異があり、知的発達遅滞や発育不全、行動異常を示す例が報告されていますが、CTCFの神経系における役割は未だ不明な点が多くあります。運動制御の中枢である小脳では、プルキンエ細胞が小脳皮質からの唯一の出力神経細胞として働いています。マウス小脳では、プルキンエ細胞でCTCFが強く発現していることから、重要な役割を果たしていることが想定されました。
本研究の成果
小脳プルキンエ細胞でCTCFを欠損させたマウスを作製し、その解析から進行性の運動機能障害を示すこと、プルキンエ細胞の樹状突起に自己回避の異常がみられること、樹状突起上の登上線維の神経支配領域が細胞体側にシフトすることを見出しました。さらに、プルキンエ細胞の樹状突起に巨大ラメラ体と呼ばれる特異な構造が形成されていることを発見しました。巨大ラメラ体は、ウェルドニッヒ・ホフマン病、13q欠失症候群、クラッベ病で報告例があり、神経変性疾患との関連が示唆されてきました。詳細な解析の結果、巨大ラメラ体は小胞体が層状に集積することで徐々に形成され、時間とともに巨大化していくことが明らかとなりました。一方で細胞核周辺の小胞体は著しく減少し、最終的にはプルキンエ細胞が小脳から消失しました。また、これに伴いCTCF欠損マウスの運動機能は著しく低下することがわかりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究は、CTCFを欠損させることで小脳プルキンエ細胞の樹状突起に巨大ラメラ体が形成されることを初めて実験的に示すことに成功しました。これまでに巨大ラメラ体の形成が報告されているウェルドニッヒ・ホフマン病、13q欠失症候群、クラッベ病の原因遺伝子がどれも異なることから、巨大ラメラ体の形成は、複数の疾患で共通する神経病理的変化である可能性が高いと考えられます。また、巨大ラメラ体の形成により、最終的にプルキンエ細胞が消失し、重篤な運動失調を引き起こすことが示唆されました。巨大ラメラ体形成のモデルマウスが確立されたことで、巨大ラメラ体形成の分子メカニズムを明らかにし、なぜ樹状突起に巨大ラメラ体が形成されるのか、また巨大ラメラ体の形成とプルキンエ細胞の消失の間にはどのような関係があるのかの解析を実験的におこなうことが可能となります。
特記事項
本研究は、2022年11月29日に英国科学誌「Acta Neuropathologica Communications」にオンライン掲載されました。
本研究は、上記の徳島大学、大阪大学に加え、自治医科大学の大野伸彦教授(生理学研究所客員教授)、広島大学の橋本浩一教授、生理学研究所の吉村由美子教授の研究グループ、およびエラスムス医療センター(オランダ)のNiels Galjart博士による協力のもと、おこなわれました。また、日本学術振興会(JSPS)科学研究費助成事業(JP16H06280、JP18H04016、JP20K06862、JP21K07294、JP22K19362)の支援を受けて実施されました。
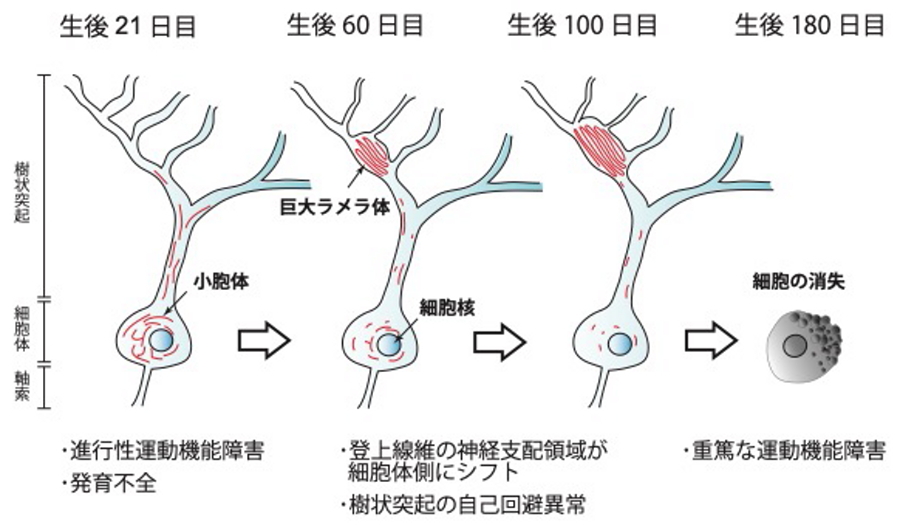
図.
CTCF欠損マウスのプルキンエ細胞で観察された巨大ラメラ体の形成過程と表現型
用語解説
- ウェルドニッヒ・ホフマン病
脊髄性筋萎縮症(指定難病3)の一種で、原因遺伝子は第5染色体のSMN(survival motor neuron)遺伝子。 - 13q欠失症候群
第13染色体の長腕の喪失によって引き起こされる染色体障害。 - クラッベ病
ライソゾーム病(指定難病19)の一種で、原因遺伝子は第14染色体のGALC(galactocerebrosidase)。 - 高次染色体構造
DNAはヒストンタンパク質に巻き付いてコンパクトに折り畳まれており、この複合体を染色体という。染色体はさらにCTCFなどのタンパク質を介して遠く離れた染色体間で結合することで、より複雑な染色体構造を形成する。これを高次染色体構造とよび、遺伝子の発現調節に働くことが知られている。 - 樹状突起
神経細胞から伸びた多数の枝状の突起。他の神経細胞から情報の入力を受けることで複雑な神経回路網の形成を担う。 - 小胞体
真核生物の細胞内にある一重の膜で囲まれた板状あるいは網状の小器官。タンパク質の立体構造の形成や輸送、カルシウムの貯蔵など多くの細胞機能に関わっている。 - 細胞核
真核生物の細胞内にある脂質二重膜で囲まれた細胞小器官の一つで、内部には遺伝情報を担うDNAが収まっている。 - 自己回避
一つの神経細胞からは多数の突起が出ているが、自分自身の突起とは交差しないように突起を伸ばす現象。 - 登上線維
延髄の下オリーブ核にある神経細胞から、小脳プルキンエ細胞の樹状突起へと伸びる神経線維。その分布は小脳の発達に伴い、プルキンエ細胞の細胞体付近から樹状突起の末端部位へと広がる。
| 原著論文 | Acta Neuropathol. Commun. 10(1):172 (2022) |
|---|---|
| 論文タイトル | CTCF loss induces giant lamellar bodies in Purkinje cell dendrites |
| 著者 | Teruyoshi Hirayama (1, 2), Yuuki Kadooka (1), Etsuko Tarusawa (1), Sei Saitoh (3, 4), Hisako Nakayama (5, 6), Natsumi Hoshino (1), Soichiro Nakama (2), Takahiro Fukuishi (2), Yudai Kawanishi (2), Hiroki Umeshima (2), Koichi Tomita (2), Yumiko Yoshimura (7, 8), Niels Galjart (9), Kouichi Hashimoto (6), Nobuhiko Ohno (10, 9), Takeshi Yagi (1)
|
| PubMed | 36447271 |
