オートファジーが損傷したリソソームを除去する仕組みを解明
膜損傷の認識に必要なユビキチン化酵素の発見
| 原著論文 | Cell Reports 40, 111349 (2022) |
|---|---|
| 論文タイトル | Identification of CUL4A- DDB1-WDFY1 as the E3 ubiquitin ligase complex to initiate lysophagy |
| 研究室サイト | 細胞内膜動態研究室 |
概要
大阪大学大学院生命機能研究科の田端桂介助教、濱崎万穂准教授、吉森保教授(大阪大学大学院医学系研究科遺伝学/大阪大学大学院生命機能研究科細胞内膜動態研究室)の研究グループは、日本たばこ産業株式会社の寺西宏文氏および産業技術総合研究所の夏目徹氏らと共同で、細胞内で分解の場として機能するリソソームが損傷した場合に、選択的に除去される新たなメカニズムを明らかにしました。
リソソームは、細胞内の分解の場としてはたらく膜に包まれた細胞内小器官であり、その内部には分解に必要な消化酵素を含んでいます。この膜が傷つくと、リソソーム内部液が細胞内に漏出し、細胞機能に影響を与え、細胞が死に至ることもあります。ヒトの体内でもリソソーム損傷は起こり、神経変性疾患や尿酸結晶性腎炎等を引き起こすことが知られています。このような事態に対応するため、細胞は損傷したリソソームを修復したり、隔離・除去したりする仕組みを持っています。
これまでに研究グループは、損傷し機能不全に陥ったリソソームが選択的に分解・除去される現象を発見し、それにはオートファジーと呼ばれる細胞内の分解機構が必要であることを明らかにしてきました。損傷したリソソームを選択的に分解するには、まず損傷部位を選択的に認識する必要があり、それには損傷リソソームのユビキチン化が重要だと考えられてきました。しかし、多くの組織では損傷リソソームがどのように認識され、ユビキチン化されるのか分かっていませんでした。
今回、研究グループは、様々な組織で発現しているCUL4A-DDB1-WDFY1タンパク質複合体が、損傷したリソソームを直接ユビキチン化するE3リガーゼとしてはたらくことを明らかにしました。さらにリソソームタンパク質であるLAMP2が、この複合体によりユビキチン化されることも明らかにしました。リソソーム膜損傷は、神経変性疾患や尿酸結晶性腎炎等に関わっていることが知られているため、今回の発見はそれらの病態発症、進行の理解につながることが期待されます。
研究の背景
オートファジーは、細胞内の成分をリソソームに運んで分解する細胞内の仕組みです。オートファジーには、細胞成分を少しずつ入れ替えたり栄養が不足したときにエネルギーを確保したりするための「非選択な分解」過程と、損傷を受けたミトコンドリアなどの細胞内小器官(オルガネラ)や、細胞内に侵入した病原体や凝集した異常蛋白質などの「選択的な分解」過程が存在することが知られています。
リソソームは様々な加水分解酵素を含む酸性のオルガネラであり、細胞外から取り込まれた成分やオートファジーで運ばれる成分はこの最終処分場で分解されます。研究グループは、これまでにリソソームが損傷を受けると、選択的なオートファジーによって除去されることを明らかにしていました。しかし、損傷したリソソームがどのように認識され除去されるのか、その仕組みについてはよくわかっていませんでした。
本研究の成果
本研究グループでは、細胞内のリソソーム膜等に人工的に損傷を引き起こす方法を確立し、その損傷膜に集積する細胞内因子を探索しました。その結果、CUL4A-DDB1-WDFY1タンパク質複合体を発見し、この複合体が損傷リソソームの除去に必要であることを明らかにしました。さらに複合体は、リソソーム膜の損傷を認識して損傷部に集積し、リソソームタンパク質であるLAMP2にK48結合型ユビキチンを付与するユビキチン化反応を引き起こすE3リガーゼ複合体として機能することを明らかにしました。またLAMP2のリソソーム内腔側の領域が、CUL4A複合体の損傷部位への集積に重要であるという結果から、本来生体膜で閉じられた環境にあるLAMP2のリソソーム内腔側の領域が、膜損傷により露出することでCUL4A複合体によって認識され、LAMP2のユビキチン化反応が起こると考えられます(図)。
研究成果のポイント
- 損傷したリソソーム膜に目印(ユビキチン鎖)を付けるユビキチン化酵素を新たに発見
- 消化酵素を含み、細胞内の分解の場として機能するリソソームの膜が損傷すると、内部液が漏出し細胞を死に至らしめることがある。リソソーム膜損傷は神経変性疾患や尿酸結晶性腎炎等と関連するため損傷膜の除去は重要であるが、そのメカニズムはわかっていなかった。
- 多くの組織で損傷リソソームがどのように認識され、オートファジーによって分解されるのか不明であった。人工ビーズを用いた膜損傷実験系を用いて、関連因子の探索を行った。
- リソソーム膜損傷が関係する神経変性疾患や尿酸結晶性腎炎等の病態発症、および老化進行の理解につながることが期待される。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、リソソーム膜が損傷するとリソソーム膜タンパク質のLAMP2がCUL4A複合体によってユビキチン化され、損傷リソソームはオートファジーにより除去されることがわかりました。リソソーム膜は、尿酸結晶やアミロイド繊維によっても損傷すると言われていますので、アルツハイマーなどの神経変性疾患や糖尿病などのアミロイド繊維関連疾患の発症機構の解明に貢献すると期待されます。また近年、損傷リソソームの増加が老化の要因であることが報告されていることから、老化進行の理解にもつながると期待されます。
研究者のコメント
細胞内分解機構であるオートファジーは、栄養源確保だけではなく細胞内を正常に維持する機能があり、様々な病態発症予防に貢献しています。細胞内小器官が損傷を受けた時に、どのような仕組みで細胞が対応するのかを更に明らかにすることで、関連病態発症機構の理解が進むことを期待しています(田端桂介)。
特記事項
本研究成果は、2022年9月14日(水)午前0時(日本時間)に米国科学誌「Cell Reports」(オンライン)に掲載されました。
なお、本研究はJST戦略的創造研究推進事業CREST(吉森保)、日本学術振興会日中韓フォーサイト事業(吉森保)、小野医学研究財団研究奨励助成(田端桂介)、UCL-OU共同研究プロジェクト(田端桂介)、科研費(濱崎万穂、田端桂介)、MSD生命科学財団研究助成(田端桂介)、新学術領域研究(濱崎万穂)の一環として行われ、日本たばこ産業株式会社の寺西宏文氏、産業技術総合研究所の夏目徹教授の協力を得て行われました。
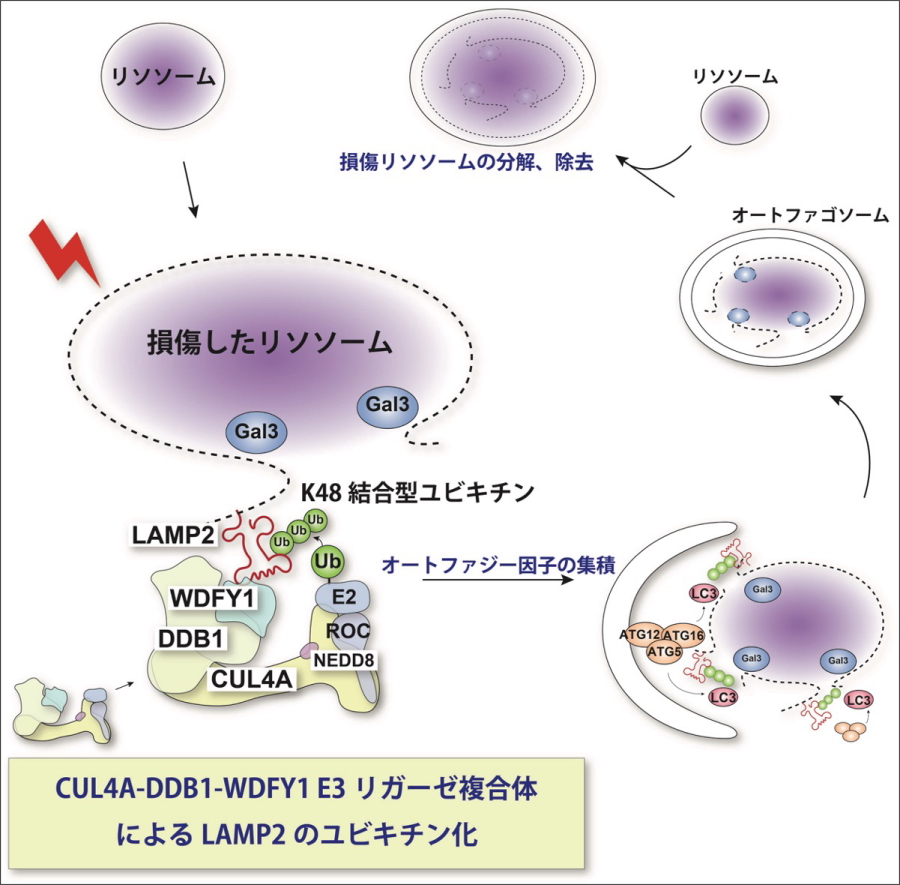
図.
リソソームが損傷すると、CUL4A-DDB1-WDFY1複合体がリソソーム膜上のLAMP2をユビキチン化する。損傷したリソソームは選択的なオートファジーによって分解・除去される。
用語解説
- リソソーム
細胞内の分解・消化の場としてはたらく細胞内小器官。タンパク質や脂質、糖質などの分解に関わる多くの加水分解酵素を含んでいる。 - ユビキチン
76個のアミノ酸からなる小さなタンパク質。通常鎖状に連なったユビキチン鎖として様々な機能を担うことが知られている。様々なタンパク質に結合し、そのタンパク質の分解や輸送、シグナル伝達などの現象に関わる。近年、オートファジーによるタンパク質分解の際に目印となることが知られるようになってきた。 - オートファジー
細胞が自己の細胞内の一部の成分を分解する仕組み。オートファゴソームと呼ばれる脂質二重膜で細胞内成分が隔離され、それがリソソームと融合した後、リソソーム内の加水分解酵素により分解される。オートファジー研究において、2016年に大隅良典博士(当時東京工業大学特任教授他)がノーベル生理学・医学賞を受賞した。 - E3リガーゼ
ユビキチン化は、E1、E2 、E3と分類されるユビキチン化酵素が順にはたらくことで、標的タンパク質にユビキチンが付与される。E3ユビキチンリガーゼは、その一連の過程で、最後に標的タンパク質にユビキチンを付与する過程を制御する酵素。ヒトゲノムには600種類以上のE3リガーゼが存在すると推定されており、標的タンパク質によって使い分けられていると考えられる。
| 原著論文 | Cell Reports 40, 111349 (2022) |
|---|---|
| 論文タイトル | Identification of CUL4A- DDB1-WDFY1 as the E3 ubiquitin ligase complex to initiate lysophagy |
| 著者 | Hirofumi Teranishi (1, 6), Keisuke Tabata (2, 3), Marika Saeki (2), Tetsuo Umemoto (2), Tomohisa Hatta (4), Takanobu Otomo (3), Kentaro Yamamoto (2), Toru Natsume (4), Tamotsu Yoshimori (2, 3, 5), Maho Hamasaki (2, 3)
|
| PubMed | 36103833 |
