オートファジー分解経路を制御する新たな因子を発見
栄養状態や分解物により選択、神経変性疾患医療への応用に期待
| 原著論文 | PLoS Genet. 18(6):e1010264 (2022) |
|---|---|
| 論文タイトル | PACSIN1 is indispensable for amphisome-lysosome fusion during basal autophagy and subsets of selective autophagy |
| 研究室サイト | 細胞内膜動態研究室 |
概要
大阪大学大学院生命機能研究科の大学院生の大江由佳子さん(博士後期課程、研究当時)、大学院医学系研究科の中村修平准教授(遺伝学/大学院生命機能研究科細胞内膜動態研究室/高等共創研究院)、吉森保教授(遺伝学/大学院生命機能研究科細胞内膜動態研究室)らの研究グループは、オートファジーの過程でできる中間体「アンフィソーム」とリソソームの融合を制御する新たなメカニズムを明らかにしました(図1)。
オートファジーが誘導されると細胞質成分(分解基質)がオートファゴソームにより隔離・輸送され、分解器官であるリソソームと融合することで内容物が分解されます。これまでこの過程には、オートファゴソームがリソソームと直接融合する経路と、アンフィソームと呼ばれる中間体を経たのちリソソームへ融合する2経路あることが知られていましたが、これらの経路を特異的に制御する因子や、2経路が存在する意義については分かっていませんでした。
今回、研究グループは、これまで全く不明であったアンフィソーム・リソソーム融合を制御する新規因子としてPACSIN1を同定しました。PACSINファミリータンパク質は細胞内の様々な膜動態に関与することが知られていますが、オートファジーとの関連は分かっていませんでした。PACSINファミリータンパク質の網羅的解析から、PACSIN1がアンフィソーム・リソソーム融合を促進することにより、恒常的に機能する基底オートファジーや特定の分解基質を特異的に認識し除去する選択的オートファジーの一部を制御していることを明らかにしました。
さらに、線虫や哺乳類培養細胞を用いた実験からPACSIN1がパーキンソン病など神経変性疾患の発症の原因となる異常タンパク質(α-シヌクレイン)凝集体の蓄積を防いでいることが分かりました。これにより、オートファジーの分子機構の理解とともに神経変性疾患の発症の予防に新たな知見をもたらすことが期待されます。
研究の背景
オートファジーが誘導されると、オートファゴソームにより隔離された分解基質は最終的にリソソームに運ばれることで分解されます。これまで、オートファジーの分解基質がリソソームへ運ばれる経路には、オートファゴソームが直接リソソームと融合する経路と、オートファゴソームがエンドソームと融合しアンフィソームと呼ばれる中間体構造物を形成した後にリソソームと融合する経路の2つの経路が存在することが知られていました。しかしながら、これらの経路を特異的に制御する因子はこれまで知られていなかったため、なぜ2つの経路が存在するのか、これら2つの経路の役割の違いについては分かっていませんでした。
本研究の成果
本研究グループは、PACSIN1遺伝子欠損細胞で基底オートファジー活性が低下していることを見出しました。そこで、活性低下の原因を調べたところ、オートファゴソームとエンドソームのハイブリッド構造体であるアンフィソームとリソソーム間の融合過程が阻害されていることが分かりました(図2)。具体的にはPACSIN1は膜融合に必要なSNAREタンパク質の複合体形成に必要なことを見出しました。さらに、PACSIN1遺伝子欠損細胞で見られるオートファジー活性の低下は飢餓により誘導されるオートファジーでは見られなかったことから、オートファジー誘導の刺激や分解基質の違いにより、2つの融合経路に使い分けがあると考えました。そこで、特定の分解基質を特異的に分解する選択的オートファジーにおいて、これらの経路に使い分けがあるかを調べました。その結果、傷害を受けたリソソームを選択的に除去するリソファジーやタンパク質凝集体を選択的に除去するアグリファジーではPACSIN1が必要である一方で、不良ミトコンドリアを選択的に除去するマイトファジーにおいてはPACSIN1が必要ではないことが分かりました。これは、オートファジーを誘導する刺激や分解基質の違いにより、2つのオートファゴソーム–リソソーム融合経路を使い分けている可能性を示唆しています。
さらに、アンフィソームを経由した融合経路の生理的な役割を明らかにするために、線虫や哺乳類培養細胞を用いてα-シヌクレイン凝集体の蓄積を調べました。α-シヌクレイン凝集体の蓄積は神経変性疾患の1つであるパーキンソン病の原因となることが知られています。コントロール線虫に対してPACSIN遺伝子欠損線虫ではα-シヌクレイン凝集体の蓄積が亢進していました(図3)。同様の結果が哺乳類培養細胞の実験からも得られました。このことから、アンフィソームを経由したオートファジー経路がタンパク質凝集体の蓄積を防いでいることが分かりました。
研究成果のポイント
- オートファジーの分解過程でできる中間体「アンフィソーム」とリソソームの融合を制御する因子としてPACSIN1を同定し、新たなメカニズムを解明。
- オートファジーの分解経路には2経路あることが知られており、その制御メカニズムと経路の役割の違いについては不明であったが、栄養状態や分解物により分解経路を使い分けている可能性を明らかにした。
- 線虫や哺乳類培養細胞を用いた実験によりPACSIN1が神経変性疾患の発症の原因となる異常タンパク質凝集体の蓄積を防いでいると示唆されたことから、オートファジーによる神経変性疾患の予防への応用が期待される。
本研究成果が社会に与える影響(本研究成果の意義)
近年、オートファジーによる細胞内の不要物のクリアランスが神経変性疾患などの発症の抑止に働いていることが明らかとなってきています。
本研究は、分解基質によりオートファジー経路に使い分けがある可能性を示唆したものであり、今後これらの経路の役割の違い、制御メカニズムをさらに詳細に解析することで神経変性疾患をはじめとするオートファジー関連疾患の治療、および予防に新たな知見をもたらすことが期待されます。
研究者のコメント
今回、アンフィソーム・リソソーム融合を制御する因子を見つけたことが、長年不明であった分解経路が2経路存在する意義についての理解につながりました。今後の研究で経路の選択を制御している因子が明らかとなれば、分解経路の選択という新たな視点からオートファジーの理解が深まることが期待されます。(大江由佳子)
特記事項
本研究成果は、米国科学誌「PLOS Genetics」に、7月1日(金)午前3時(日本時間)に公開されました。
なお、本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST研究領域「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」における研究課題「オートファジーによる細胞外微粒子応答と形成」(研究代表者:吉森保)「JPMJCR17H6」、文部科学省学術変革領域研究B「TFEB依存的・非依存的ポストリソソームシグナルによる個体および生殖寿命制御機構」(研究代表者:中村修平)「21H05145」、日本学術振興会基盤研究B「LC3による非オートファジー機能を介した損傷リソソーム修復機構の解明」(研究代表者:中村修平)「21H02428」のサポートを受けて実施されました。
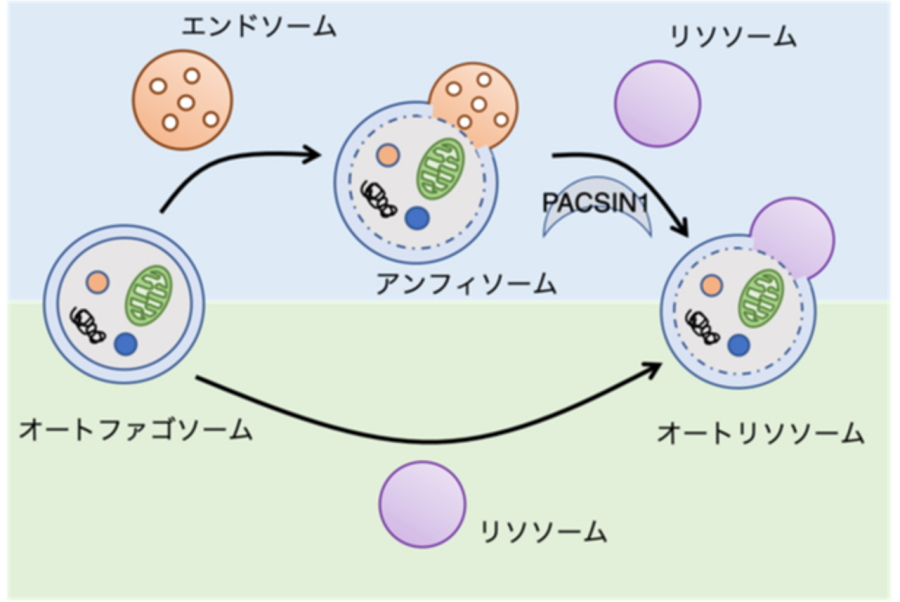
図1.研究概略図
オートファジーの分解経路は2経路存在する。このうち、PACSIN1はアンフィソーム・リソソーム間の融合を制御する。
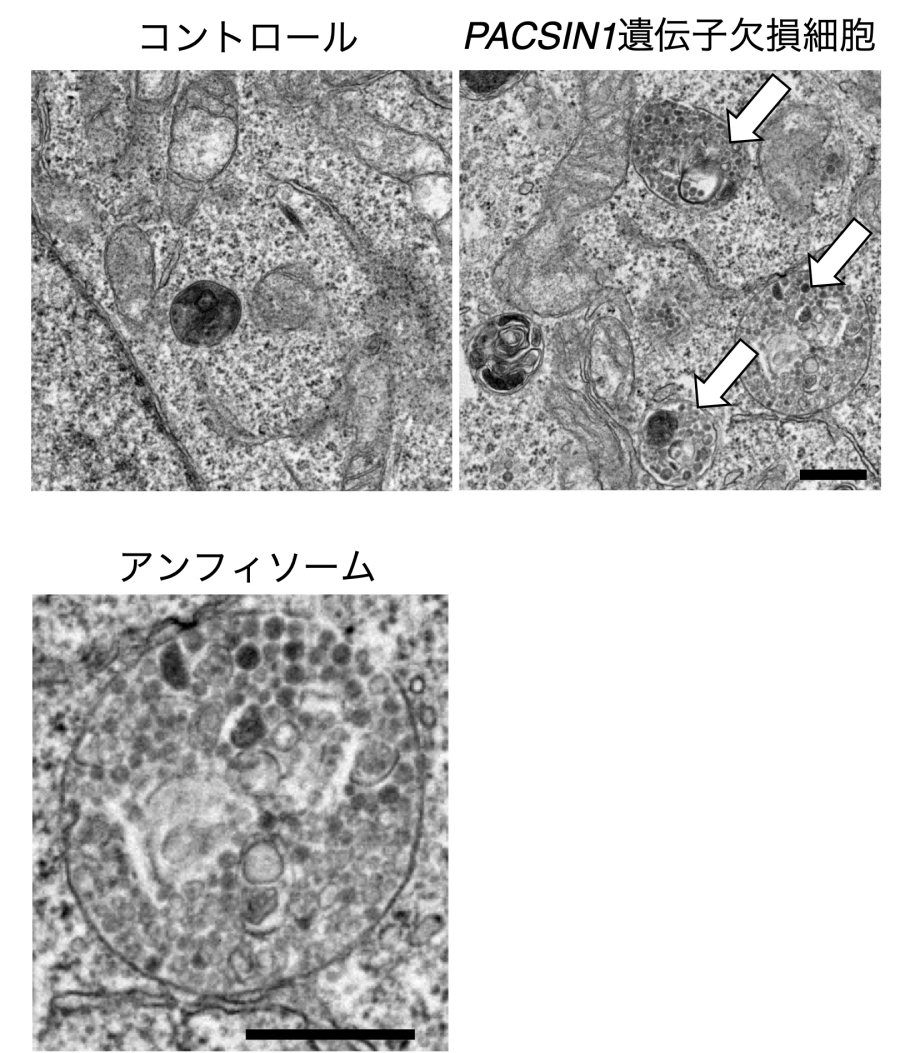
図2.PACSIN1遺伝子欠損細胞ではアンフィソームが蓄積する
上:電子顕微鏡による細胞の超微細構造。コントロール細胞と比較してPACSIN1遺伝子欠損細胞ではアンフィソーム(矢印)が蓄積している。下:蓄積しているアンフィソームの超微細構造。スケールバー、500nm。
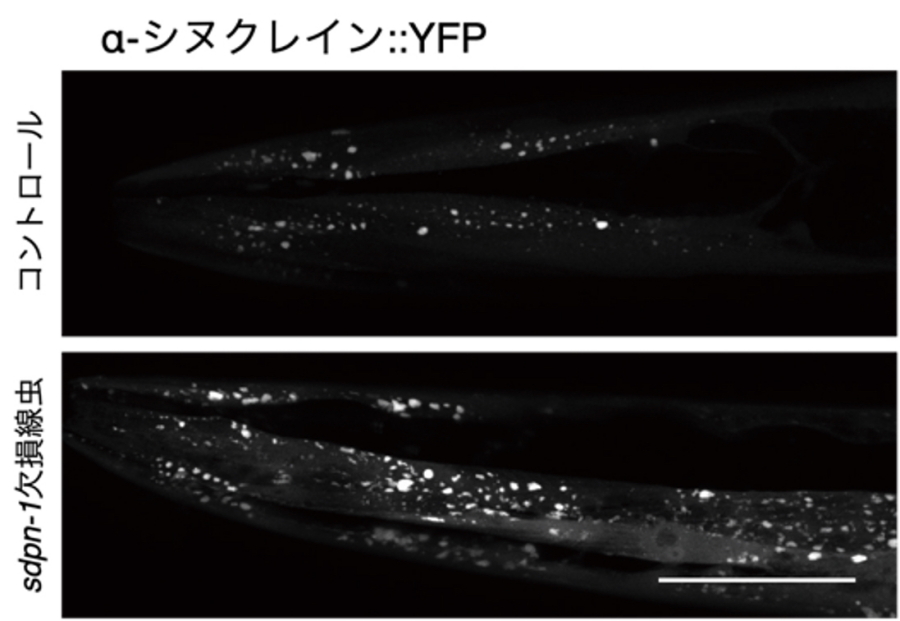
図3.PACSIN遺伝子欠損線虫では加齢に伴うα-シヌクレイン凝集体の蓄積が増悪する
コントロール(上)と比較し、PACSINの線虫ホモログであるsdpn-1欠損線虫(下)ではα-シヌクレイン凝集体の蓄積が亢進する。スケールバー、50μm。
用語解説
- オートファジー
細胞の自己分解システム。細胞内のタンパク質や細胞小器官を二重膜構造体(オートファゴソーム)で包み込み、内部に消化酵素を含むリソソームへと輸送することで隔離した内容物を分解する。オートファゴソームがリソソームと融合する経路は、直接リソソームと融合する経路と、エンドソームと融合しアンフィソームと呼ばれる中間体構造物を形成したのちにリソソームと融合する経路の2経路が存在する。また、オートファジーは恒常的に機能する基底オートファジーや、特定の分解基質を特異的に認識し除去する選択的オートファジーなどがある。近年、オートファジーによる細胞内浄化作用が神経変性疾患をはじめ、様々な疾患の発症を抑止していると考えられている。 - アンフィソーム
オートファゴソームとエンドソームが融合してできるハイブリッド構造体。さらに、リソソームと融合することでリソソームの加水分解酵素により中身の分解を受ける。 - α-シヌクレイン
中枢神経において豊富に存在するタンパク質。神経変性疾患であるパーキンソン病やレビー小体型認知症などにおいて繊維状凝集体を蓄積することが知られている。
| 原著論文 | PLoS Genet. 18(6):e1010264 (2022) |
|---|---|
| 論文タイトル | PACSIN1 is indispensable for amphisome-lysosome fusion during basal autophagy and subsets of selective autophagy |
| 著者 | Yukako Oe (1), Keita Kakuda (2), Shin-ichiro Yoshimura (3), Naohiro Hara (4), Junya Hasegawa (5), Seigo Terawaki (6), Yasuyoshi Kimura (2), Kensuke Ikenaka (2), Shiro Suetsugu (7, 8, 9), Hideki Mochizuki (2), Tamotsu Yoshimori (1, 4, 10), Shuhei Nakamura (1, 4, 11)
|
| PubMed | 35771772 |
