DNA複製へのスイッチ、鍵は何?
細胞増殖へ進むか止まるか、正常な細胞とがん細胞の違いを発見
| 原著論文 | Nucleic Acids Res. 49(21):12152-12166 (2021) |
|---|---|
| 論文タイトル | Chromatin loading of MCM hexamers is associated with di-/tri-methylation of histone H4K20 toward S phase entry |
| 研究室サイト | 細胞核ダイナミクス研究室 |
概要
大阪大学大学院生命機能研究科の林陽子特任助教(常勤)、平岡泰教授らの研究グループは、G1期の複製開始複合体MCM複合体の形成がヒストン修飾の変化によって制御されることを世界で初めて明らかにしました。
細胞が増殖するためには、DNAが複製される必要があります。DNAを複製する時期は、S期、その前の準備の期間は、G1期と呼ばれます。G1期は、細胞増殖のために複製期に進行するか、そのまま細胞周期の進行を停止するかを決める重要な時期です。MCM複合体はDNA複製を行う際にDNAのねじれを解く役割があり、S期の開始までには(つまり、G1期の終了までに)クロマチン上でMCM複合体の六量体単体(シングル)から六量体が2つ連結した状態(ダブル)に遷移することが知られていました。しかしながら、G1期の長い(〜数十時間)ヒト細胞において、どのような過程を経てダブル六量体が形成されるのかは不明でした。
今回、ヒト細胞ではG1期に進行したばかりの初期には、MCMはシングル六量体の状態にあり、S期が始まる3~4時間前(G1期後期)になって初めてダブル六量体を形成することが分かりました(図1)。また、この変化に先行して、ヒストンH4K20におけるヒストンメチル化修飾がモノメチル化からジ・トリメチル化への転換することが必須であることが分かりました。細胞周期の長い細胞では、MCMはシングル六量体の状態で留まることから、MCMの状態変化はDNA複製への進行過程を反映するものであり、細胞増殖の理解に繋がる重要な発見と言えます。
研究の背景
真核生物のDNA複製は、常に複製起点と呼ばれるDNA領域から開始されます。DNA複製が開始するためには、まず複製開始複合体が複製起点に結合する必要があります。
複製開始複合体の一因子MCM(シングル六量体)は、DNAに結合しねじれを解く働きがあると知られていました。DNA複製は両方向に向かって進行することから、2セットのMCM(ダブル六量体)が必要になります。しかしながらMCMが、どのようにダブル六量体を形成するかは明らかではありませんでした。
本研究の成果
研究グループでは、hTERT-RPE1細胞(不死化ヒト網膜色素上皮細胞)を用いて、シングルセルプロット解析法によりクロマチン画分に結合するMCM量が細胞周期の進行にともなってどのように変化するかを調べました(図2)。MCM量は、G1期初期では少~中程度だったのに対し、G1期後期になると多くなることが分かりました。
次に、G1期初期とG1期後期におけるMCM量の違いが何によるかを調べるために、ショ糖密度勾配法(図3)によって生化学的に調べました。その結果、G1期初期ではMCMはシングル六量体であり、G1期後期ではダブル六量体を形成することがわかりました。
細胞周期のフェーズがどの程度の長さかを複数の細胞で調べました(図4)。MCMのクロマチン結合量の多いG1期後期は3~4時間程度で、癌細胞のように増殖が盛んな細胞でも、正常細胞のように細胞周期が長い細胞でもほとんど変わりませんでした。つまり、一度クロマチンに結合するMCM量が多くなると3~4時間程度で複製期に移行することになります。一方で、MCM量が少~中程度のG1期初期は、癌細胞では7~8時間程度だったのに対し、細胞周期の長い細胞では数十時間にも及びました。この結果は、細胞周期の長さはG1期初期の長さに大きく影響を受けることを示唆していました。
さらに、このMCMがシングル六量体からダブル六量体を形成する前に、ヒストンH4K20me1がme2/me3になることがわかりました(図5)。ヒストンH4K20me2/me3への変化を阻害すると、MCMはダブル六量体を形成できずシングル六量体で留まることから、G1期の進行においてヒストンメチル化修飾がme1からme2/me3に変化することが必須であることになります。ヒストン修飾はエピジェネティクス制御に関わり遺伝子発現に関与することが報告されていますが、今回の結果から遺伝子発現だけでなく細胞周期のG1期の進行にも重要な働きを持つことが分かりました。
研究成果のポイント
- DNA複製開始に必要な複製開始複合体、MCM(ミニクロモソーム・メンテナンス)のダブル六量体形成にヒストン修飾が関与
- ヒト細胞では細胞周期G1期の進行に伴いMCM六量体がシングルからダブルの状態に変化
- 正常細胞ではMCMのシングル六量体の時間が長いが、ダブル六量体になると一定時間を経てDNA複製へ進行
- 癌細胞と正常細胞のMCMタンパク質の状態の違いから、癌細胞を標的とした創薬への応用に期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、細胞周期、G1期の進行はヒストンメチル化修飾に依存することが分かりました。ヒストン修飾はエピジェネティクス制御に関わることから、遺伝子発現制御と細胞周期との関係が注目されます。また癌細胞と正常細胞の細胞周期の長さの違いはG1期初期の状態に依ることから、癌細胞を標的とした創薬への応用も期待されます。
研究者のコメント
初めてMCMタンパク質の免疫染色を行ってから、本論文を受理されるまでには長い時間がかかりました。その間、多くの方々に支えられて研究を続けることが出来たことに本当に感謝しております。研究に関する試薬などには公益財団法人浦上食品・食文化振興財団に、次世代シーケンス費には九州大学生体防御医学研究所「多階層生体防御システム研究拠点」の共同利用・共同研究に、また論文の英文校閲および投稿費に関しては大阪大学の研究推進部研究推進課研究プロジェクト推進係に本当にお世話になりました。どうもありがとうございました。(林陽子)
特記事項
本研究成果により、細胞周期、G1期の進行はヒストンメチル化修飾に依存することが分かりました。ヒストン修飾はエピジェネティクス制御に関わることから、遺伝子発現制御と細胞周期との関係が注目されます。また癌細胞と正常細胞の細胞周期の長さの違いはG1期初期の状態に依ることから、癌細胞を標的とした創薬への応用も期待されます。
本研究成果は、イギリス科学誌「Nucleic Acids Research」に、11月19日(金)9時(日本時間)に公開されました。
なお、本研究は、浦上食品・食文化振興財団(林陽子)、内藤記念科学振興財団(林陽子)、日本学術振興会科学研究費助成事業新学術領域研究「減数分裂における細胞核・クロマチン構造の変換メカニズム(研究代表者:平岡泰)」、同新学術領域研究「クロマチン機能を保証する核膜の構造と分子基盤(研究代表者:原口徳子)」、同新学術領域研究「細胞核・クロマチン構造のダイナミクスと遺伝子制御(研究代表者:木村宏)」、同新学術領域研究「再構成とエピゲノム編集による初期胚核の機能性獲得機序の理解(研究代表者:山縣一夫)」、同新学術領域研究「空間トランスオミクス技術の開発(研究代表者:大川恭行)」、同新学術領域研究「高転写状態獲得を理解するためのエピゲノム・トランスクリプトーム解析技術の開発(研究代表者:大川恭行)」、同新学術領域研究「高深度解析を可能とする単一細胞空間オミクス技術の開発(研究代表者:大川恭行)」、同新学術領域研究「ヘテロクロマチン構造形成の分子機構(研究代表者:中山潤一)」、同新学術領域研究「ヘテロクロマチンボディーの構築原理の解明(研究代表者:小布施力史)」、同基盤研究A(平岡泰、大川恭行)、同基盤研究B(大川恭行、原口徳子、小布施力史)、同萌芽研究(大川恭行)の一環として行われました。
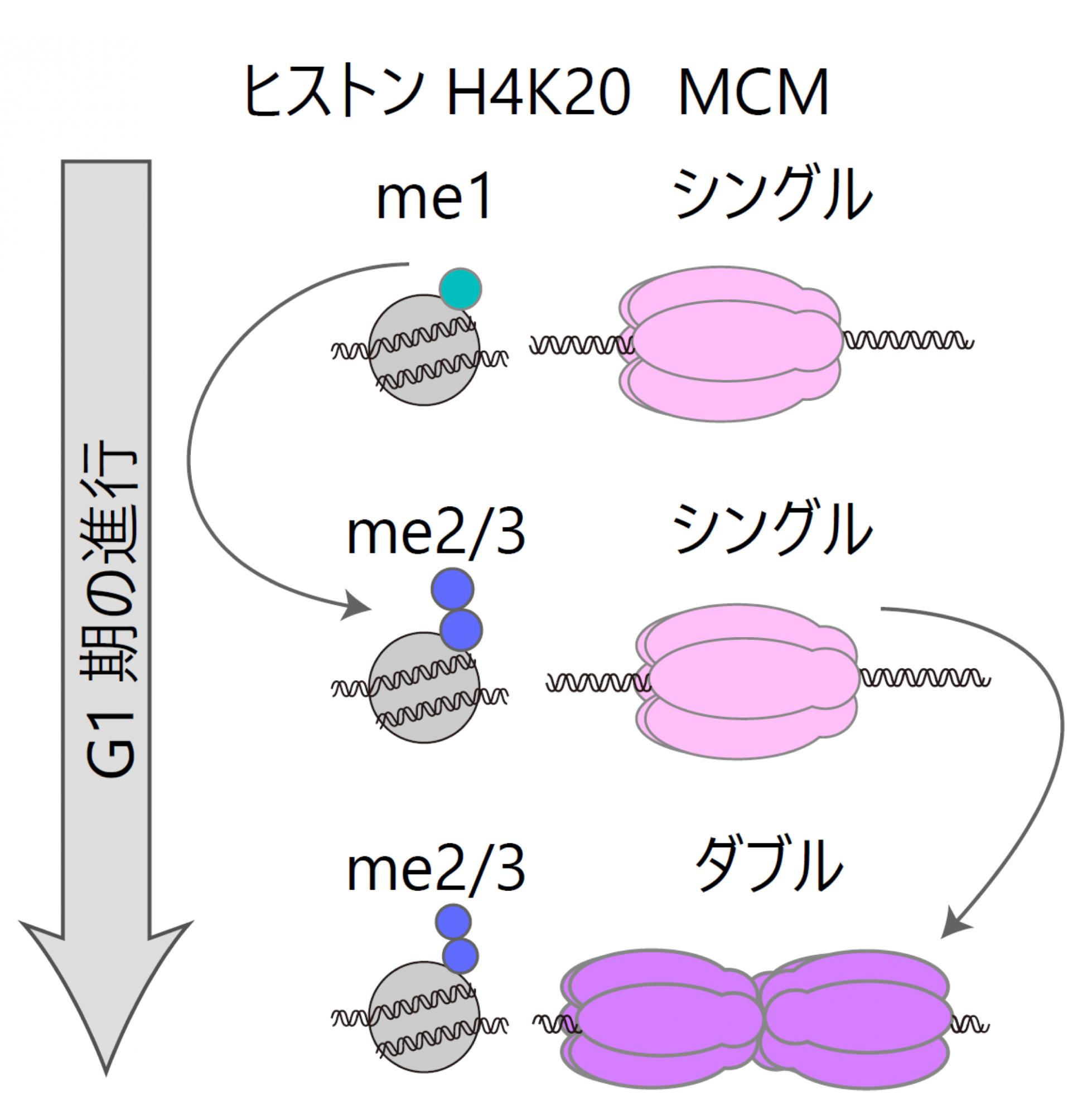
図1.MCMの変化とヒストン修飾
MCMタンパク質は複製期が始まる前までにダブル六量体を形成する必要がある。G1期におけるシングル六量体からダブル六量体の変化には、ヒストンH4K20修飾のモノメチル化(me1)からジ・トリメチル化(me2・me3)への転換が必須であることがわかった。
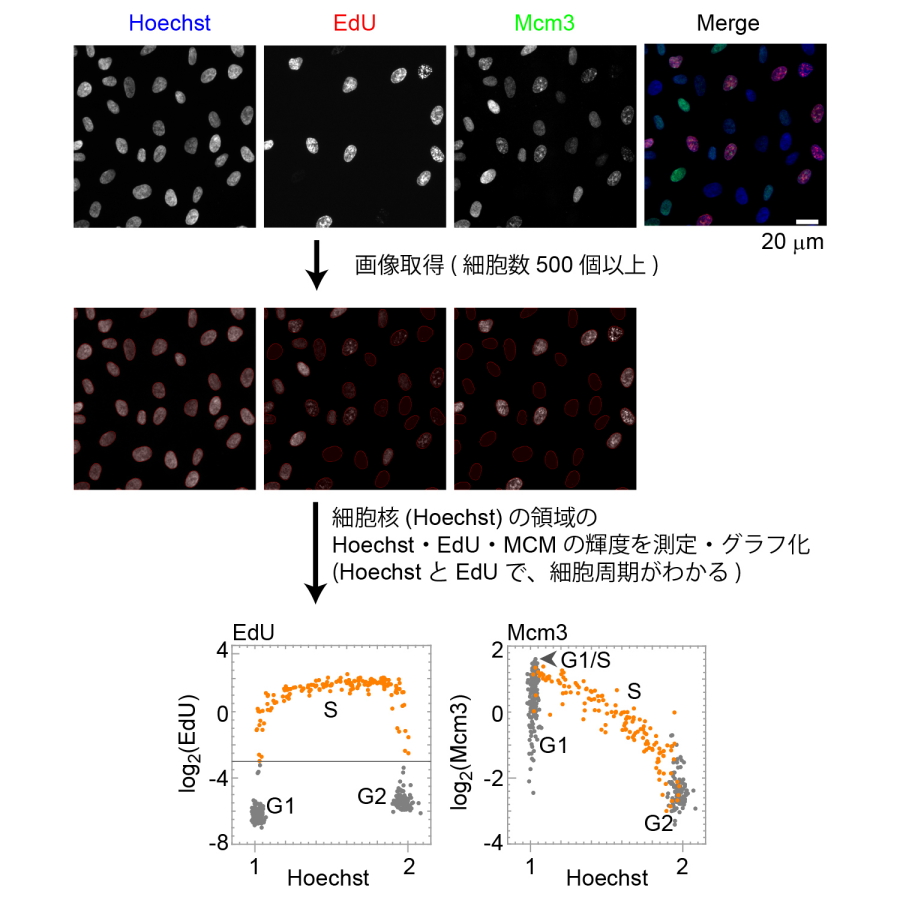
図2.シングルセルプロット解析によるMCMタンパク質の細胞周期における変化
(上段)DNAを染色するHoechst、S期のマーカーであるEdUおよびMCMに対する抗体で免疫染色を行った。(中段)細胞核(Hoechst)の領域内のそれぞれの輝度を測定した。(下段)横軸にHoechstをとってグラフ化した。(左)EdUの高い領域はS期(オレンジ色)、Hoechstの低いグレー領域はG1期、高いグレー領域はG2期となる。(右)縦軸をMCMで表した。左でオレンジ色のS期のものは、右でもオレンジ色で示した。MCMのG1期は値が大きく変化することが分かる。
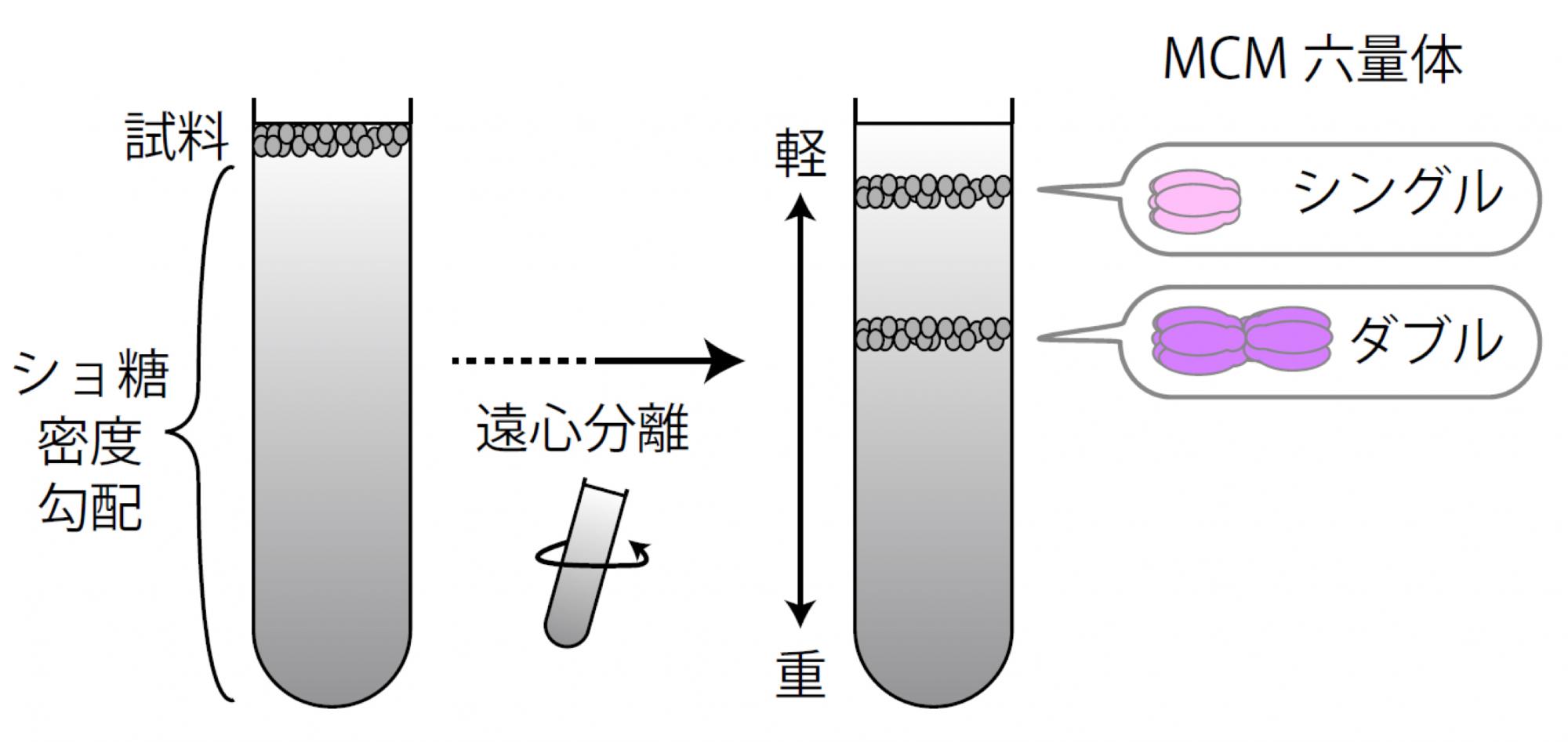
図3.ショ糖密度勾配法によるMCMタンパク質の分画
ショ糖密度勾配法で遠心分離を行い、密度の低い物質と高い物質を分離する。MCMのシングル六量体とダブル六量体はそれぞれ異なる密度であることから、どの位置にMCMが存在するかによって、シングルかダブルかが判別できる。
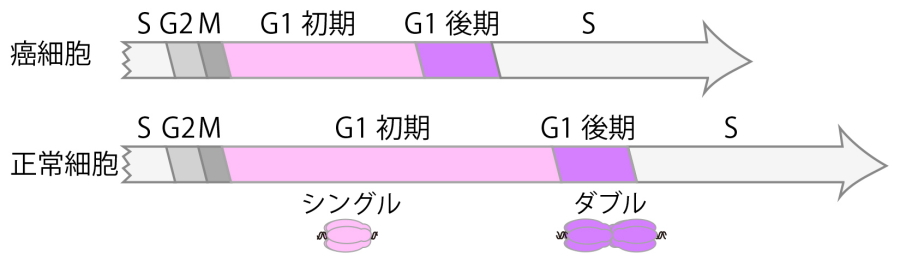
図4.癌細胞と正常細胞の細胞周期の長さの違い
G1期後期・S期・M期の長さは、癌細胞と正常細胞の長さは変わらなかった。一方で細胞周期の長い正常細胞では、G1期初期の長さも長いことがわかった。
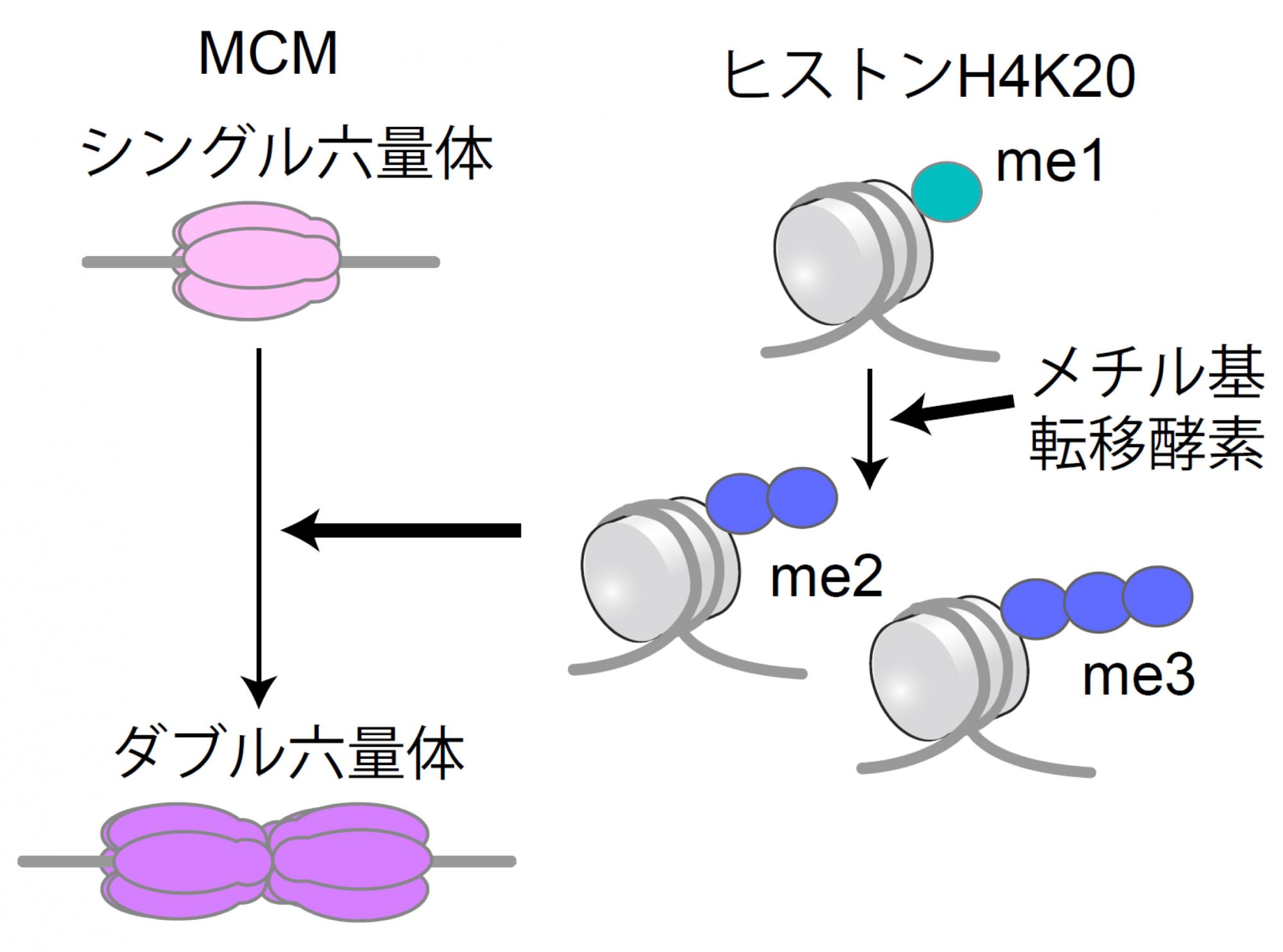
図5.ヒストンメチル基転移酵素の働き
ヒストンH4K20me1からme2/me3へ転移させるメチル基転移酵素が働くことで、MCMはシングル六量体からダブル六量体を形成する。
用語解説
- 複製開始複合体
複製開始起点に結合する4種類のタンパク質からなる複合体。この複合体の形成によって、DNA複製が開始される。 - MCM(ミニクロモソーム・メンテナンス)
minichromosome maintenance。複製開始複合体の一因子。6つの構成タンパク質から成るリング状のヘキサマーであり、DNAヘリケースとして働く。DNA複製は両方向に進むことから、複製期が始まる前までにダブルヘキサマーをDNA上に形成する必要がある。 - ヒストン修飾
ヒストンとは、真核生物のクロマチンの基本単位であるヌクレオソーム(nucleosome)を構成する塩基性タンパク質で、DNAを核内に収納する働きを持つ。真核生物では、DNAは4種類のコアヒストン(H2A、H2B、H3、H4)から成るヒストン8量体に巻き付いて、ヌクレオソームを形成。このDNAとヒストンの複合体であるヌクレオソームが連なった構造をクロマチンと呼ぶ。ヒストンのN末端領域は、アセチル化、メチル化、リン酸化、モノユビキチン化など様々な翻訳後修飾を受けることが報告されており、この修飾を総じてヒストン修飾と呼ぶ。これらの修飾はクロマチン構造を変化させ、エピジェネティックな遺伝子発現制御に関わっていると考えられている。 - 細胞周期
一つの細胞が二つの娘細胞生み出す過程で起こる一連の事象、およびその周期のこと。一般に細胞周期は、G1、S、G2、M期から構成される。S期にはDNAの複製、M期には細胞分裂が行われる。 - G1期
細胞周期の時期のひとつで、M期が終わってからS期が始まるまでの期間。G1期は、細胞増殖のためにS期に進行するか、細胞増殖を休止・停止するかを決定する重要な時期である。 - クロマチン
真核生物の細胞核にあるDNAとタンパク質(主にヒストン)の複合体。 - ヒストンH4K20
ヒストンのメチル化修飾は主にリジン残基に見られ、モノメチル化(me1)、ジメチル化(me2)、トリメチル化(me3)の三段階の状態がある。 - シングルセルプロット解析法
蛍光顕微鏡で取得した画像の輝度をグラフ化する手法。焦点の合わない細胞や不完全な形のものを除くことで、フローサイトメトリーよりも精度の高い結果が得られる。特別な機材は必要とせず汎用の顕微鏡による画像を用いるため、特異的な認識抗体さえ手に入れば非常に応用範囲の広い手法である。 - ショ糖密度勾配法
実験手法で、遠心チューブの底部から上部に向けて次第に濃度が低下するようにショ糖溶液の密度勾配を作り、最上部に試料を重層する。チューブを遠心することで試料中に含まれる物質を大きさや重さに応じて分離分画する方法。図3参照。 - 免疫染色
抗原抗体反応という免疫反応を利用して、特定の物質を染色する方法。 - エピジェネティクス制御
遺伝子発現に関わるゲノム領域の活性化状態を調節し、そしてその状態を細胞が分裂した後も記憶し、継承するしくみ。
| 原著論文 | Nucleic Acids Res. 49(21):12152-12166 (2021) |
|---|---|
| 論文タイトル | Chromatin loading of MCM hexamers is associated with di-/tri-methylation of histone H4K20 toward S phase entry |
| 著者 | Yoko Hayashi-Takanaka (1), Yuichiro Hayashi (2), Yasuhiro Hirano (1), Atsuko Miyawaki-Kuwakado (3), Yasuyuki Ohkawa (3), Chikashi Obuse (4), Hiroshi Kimura (5), Tokuko Haraguchi (1), Yasushi Hiraoka (1)
|
| PubMed | 34817054 |
