抗がん剤後の骨髄回復を促す新たなメカニズムを発見!
自然リンパ球による緊急回復スイッチの作動
| 原著論文 | J. Exp. Med. 218(5):e20200817 (2021) |
|---|---|
| 論文タイトル | Group 2 innate lymphoid cells support hematopoietic recovery under stress conditions |
| 研究室サイト | 免疫細胞生物学研究室〈石井 優 教授〉 |
概要
大阪大学大学院生命機能研究科の數藤孝雄助教、石井優教授(免疫細胞生物学)らの研究グループは、骨髄中の2型自然リンパ球が、抗がん剤治療後の骨髄傷害を感知し、顆粒球単球コロニー刺激因子(GM-CSF)を分泌することで血球数の回復に関わることを世界で初めて明らかにしました。
抗がん剤治療の副作用として白血球などの血球細胞は減少します。その後、骨髄内では生き残った造血前駆細胞が盛んに分裂し、血球を増やそうとしますが、これまでそのメカニズムはよく分かっていませんでした。
今回、石井優教授らの研究グループは、骨髄内に存在する免疫細胞の一種である2型自然リンパ球が、抗がん剤治療後に生き残った造血前駆細胞が増殖するよう働きかけていることを明らかにしました(図1)。
研究グループは、抗がん剤治療後の骨髄に移植された造血前駆細胞の遺伝子発現を調べることによって、GM-CSFの刺激を受けて増殖していることを突き止めました。また、骨髄内の様々な細胞について、「1細胞RNA解析」という手法を用いることによって、免疫細胞の一種である2型自然リンパ球がGM-CSFを分泌していることを突きとめました。骨髄内の2型自然リンパ球は、普段GM-CSFを分泌していませんが、抗がん剤の刺激を受けると性質を変化させてGM-CSFを分泌することが分かりました。2型自然リンパ球をマウスの骨髄から採取して培養し、体外で増やし、抗がん剤投与後のマウスに移植することで、血球細胞の回復が早まることが分かりました。今後、抗がん剤治療や骨髄移植後の白血球減少症の治療に繋がる可能性が期待されます。
研究の背景
白血球などの血球細胞は、骨髄内に存在する造血前駆細胞から産生されます。通常は作られる細胞と壊される細胞のバランスがとられ、骨髄の細胞数はほぼ一定の数に保たれています。しかし抗がん剤治療を受けると、副作用として骨髄中の血球細胞が大きく減少し、感染症リスクが上がってしまいます。そのため骨髄内では生き残った造血前駆細胞が盛んに分裂し、血球を増やそうとしますが、これまでそのメカニズムはよく分かっていませんでした。抗がん剤治療後の血球回復がどのようなメカニズムで起こるのかを明らかにすることによって、骨髄での造血システムの解明が進み、血球細胞を増やすことを目的とした臨床応用にも役立つと考えられます。
本研究の成果
石井教授らの研究グループは、生きた動物の生きた細胞を可視化する「生体イメージング技術」を用いて、抗がん剤投与後の骨髄に移植された造血前駆細胞の動きが通常と異なることに着目しました。この造血前駆細胞の遺伝子発現を網羅的に調べることによって、抗がん剤投与後の骨髄環境からGM-CSFの刺激を受けて増殖していることが分かりました。「1細胞RNA解析」という手法を用いて、各細胞の遺伝子発現を詳しく調べたところ、2型自然リンパ球がGM-CSFを分泌していることを突きとめました(図2)。このリンパ球は、普段活発にGM-CSFを分泌していませんが、骨髄の中で細胞死が起こるとそれを感知し、GM-CSFの遺伝子発現を上昇させることが分かりました。2型自然リンパ球をマウスの骨髄から採取して培養し、体外で増やし、抗がん剤投与後のマウスに移植すると、造血細胞の回復が早まることが分かりました(図3)。
研究成果のポイント
- 抗がん剤投与の副作用によって骨髄内の多くの血球細胞が死滅し、骨髄環境が危機的状況になる。その中でもB細胞前駆細胞が死ぬときに放出されるサイトカインという物質が、骨髄内の2型自然リンパ球(group 2 innate lymphoid cell; ILC2)を活性化させてGM-CSF(顆粒球単球コロニー刺激因子:granulocyte macrophage colony stimulating factor)の生産を誘導し、これが緊急回復スイッチとして血球細胞の増殖を促す。即ち2型自然リンパ球は周りの死んだ細胞から「骨髄危機状況・細胞死シグナル」を受けて性質を変化させ、骨髄機能回復に関わることが分かった。
- 2型自然リンパ球を体外で増やし、抗がん剤投与後のマウスに移植することで、血球細胞の回復が早まることが分かった。これらの発見は、抗がん剤治療や骨髄移植後の白血球減少症の治療に繋がる可能性がある。
本研究成果が社会に与える影響(本研究成果の意義)
生体は元々、抗がん剤で傷ついた骨髄を再生させる能力がありますが、本研究はその再生メカニズムの一つを明らかにしました。本研究成果により、血球細胞を体外で増やす方法の開発や、抗がん剤治療や骨髄移植後の白血球減少症の治療法開発に役立つと考えられます。
特記事項
本研究成果は、2021年3月6日(土)午前0時(日本時間)に米国科学誌「Journal of Experimental Medicine」(オンライン)に掲載されました。
本研究成果は、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業CREST「生体制御の機能解明に資する統合1細胞解析基盤技術の創出」研究領域(研究総括:菅野純夫(東京医科歯科大学難治疾患研究所 非常勤講師))における「動く1細胞の「意思」を読み取るin vivo網羅的動態・発現解析法の開発」(研究代表者:石井優(大阪大学先導的学際研究機構生命医科学融合フロンティア研究部門/大学院生命機能研究科/大学院医学系研究科/免疫学フロンティア研究センター 教授))(JPMJCR15G1)の一環として得られました。
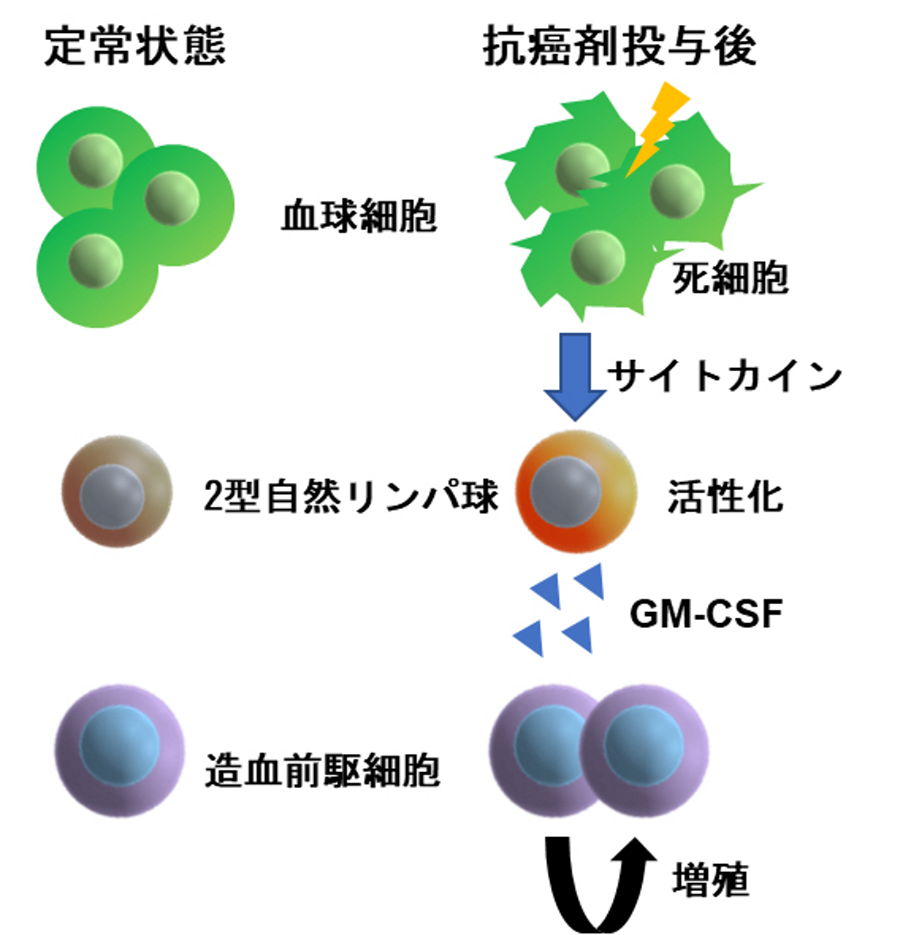
図1.抗がん剤投与後の骨髄回復メカニズム
抗がん剤投与後に2型自然リンパ球は死細胞が放出するサイトカインを認識し、GM-CSFを分泌して血球回復に寄与する。
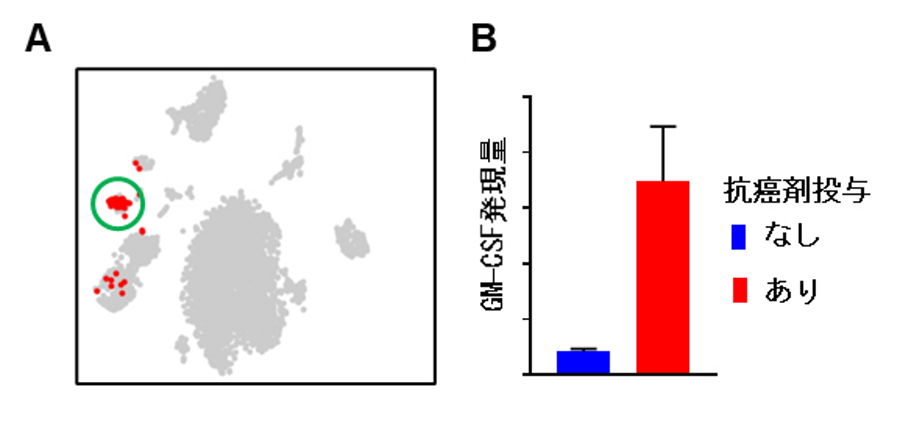
図2.自然リンパ球は抗がん剤投与に反応してGM-CSFを産生する。
A.1細胞RNA-seqによるGM-CSF発現細胞の描出。緑の丸で囲まれた細胞集団が2型自然リンパ球を表す。B.抗がん剤投与後の2型自然リンパ球はGM-CSFを産生する。
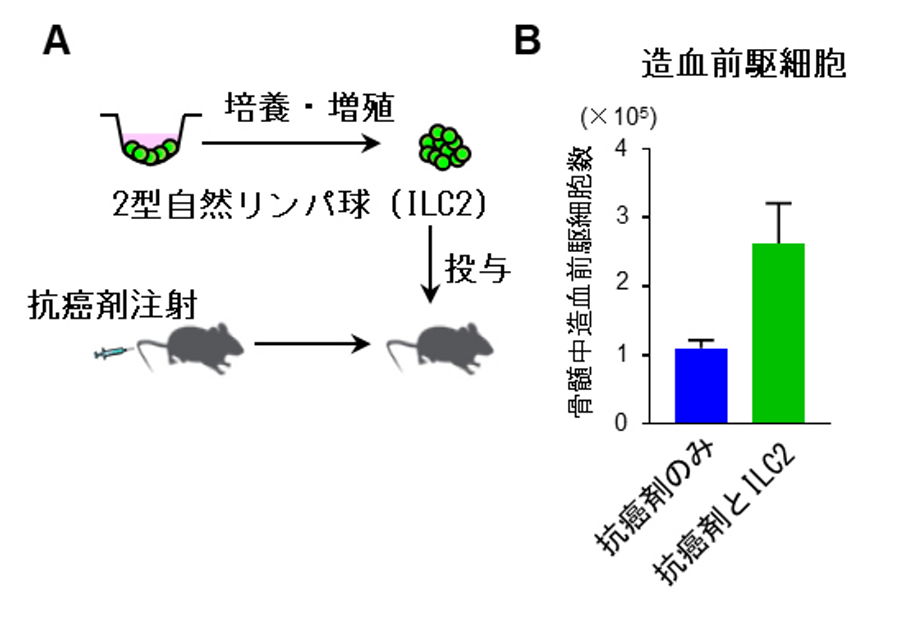
図3.2型自然リンパ球投与により血球回復は早くなる。
A.2型自然リンパ球(ILC2)を培養し、抗がん剤投与したマウスに注射した。B.ILC2投与によって造血前駆細胞数が増えた。
用語解説
- 2型自然リンパ球(group 2 innate lymphoid cell; ILC2)
インターロイキン(IL)-5、IL-13などのサイトカインを産生する自然免疫細胞の一種。寄生虫に対する防御や組織修復を担っているが、活性化によりアレルギー疾患を悪化させることもある。 - GM-CSF(顆粒球単球コロニー刺激因子:granulocyte macrophage colony stimulating factor)
顆粒球、マクロファージ、樹状細胞などの生存、増殖、分化を促すサイトカインの一つ。GM-CSFは造血前駆細胞に作用し、白血球数を増加させる。 - 造血前駆細胞
白血球や赤血球などの血球細胞に分化することができる細胞。骨髄に存在し、分裂・増殖によって多量の血球細胞を生み出す。 - 1細胞RNA解析(single-cell RNA sequencing)
1つの細胞に含まれるメッセンジャーRNAからcDNAを作成し、増幅した後に次世代シークエンサーを用いて読み取ることで、様々な種類の遺伝子の発現量を細胞毎に定量解析する手法。 - 生体イメージング技術
生きた組織・臓器の内部を観察し、細胞や分子の動きをリアルタイムで解析する手法。
| 原著論文 | J. Exp. Med. 218(5):e20200817 (2021) |
|---|---|
| 論文タイトル | Group 2 innate lymphoid cells support hematopoietic recovery under stress conditions |
| 著者 | Takao Sudo (1, 2, 3), Yasutaka Motomura (2, 4, 5), Daisuke Okuzaki (6, 7), Tetsuo Hasegawa (1), Takafumi Yokota (3), Junichi Kikuta (1, 2, 8), Tomoka Ao (1, 8), Hiroki Mizuno (1, 2), Takahiro Matsui (1, 9), Daisuke Motooka (6, 7), Ryosuke Yoshizawa (1), Takashi Nagasawa (2, 10), Yuzuru Kanakura (3), Kazuyo Moro (2, 4, 5), Masaru Ishii (1, 2, 8)
|
| PubMed | 33666647 |
