生物が持っている全遺伝情報はゲノムと呼ばれます。ゲノムの本体はDNAと呼ばれる核酸の重合体ですが、生きた細胞の核の中ではそれがヒストン蛋白質の八量体に巻き付いたヌクレオソーム構造を基本としたクロマチン構造をとっており、それが染色体として細胞核の中に収納されています。生命活動のための情報は、DNA配列の情報を元にして発現しますが、その一方でヒストンやDNAの修飾に代表されるエピジェネティクスによっても調節されます。それらの調節によって、染色体にコードされている情報が細胞の生長や個体の発生の段階に応じて適切に発現するのです。クロマチンが担う多様な活動のためには、多くの蛋白質との相互作用が必要です。私たちは、分裂酵母細胞と培養細胞をモデルとして、細胞核で見られる動的な活動をとらえ、その構造と機能の原理を明らかにしたいと考えています。
酵母染色体
分裂酵母は一倍体で増殖する単細胞の菌類の一種で、染色体DNAのサイズが約1400万塩基対と真核生物の中では比較的小さく、一倍体の染色体数が3本と少ないことが特徴ですが、高等真核細胞が持っている性質をほとんどすべて備えていることから、モデル生物として世界的に研究に使われています。特に相同組み換えによって人為的な遺伝子導入や遺伝子破壊ができることや、交雑によって遺伝解析ができることは研究を進める上で大きな利点です。私たちは分裂酵母を使って次のような研究を進めています。
1.酵母における染色体ダイナミクス~減数分裂時の染色体配向~
染色体は細胞核の中で規則性のある配置をとることが知られています。体細胞分裂間期の細胞核では動原体(セントロメア)が核膜の外層にある中心体の近傍にクラスターし、染色体末端(テロメア)は核膜上に散在します(ラブル配向:Rable orientation)。一方,減数分裂の一時期では、テロメアが中心体の近傍に束ねられたような配置をとり、セントロメアは中心体から離れます(ブーケ配向:bouquet orientation)。分裂酵母はこのような染色体の核内配置を示す典型的な生物です(図1、2)。特に、ブーケ配向構造をとった分裂酵母の染色体は、馬の尾のように細く伸びた形態で観察され、細胞内を往復運動することが特徴です。私たちは、分裂酵母のブーケ配向がどのような構造で成り立っているか、またブーケ配向と減数分裂の過程にどんな関係があるのかを、生細胞蛍光イメージング(Fluorescence maicroscopeの項参照)や分子遺伝学的手法を使って調べています。

図1.分裂酵母で見られる染色体配向構造の変化
間期核ではセントロメア(centromere)がスピンドル極体(SPB)付近に位置し、テロメア(telomere)は核膜上に位置しているが、減数分裂前期ではテロメア結合蛋白質・核膜蛋白質・微小管モーター蛋白質の働きによってテロメアがSPBに集合し、セントロメアがSPBから離れる。
動画でもご覧いただけます。こちらをどうぞ。
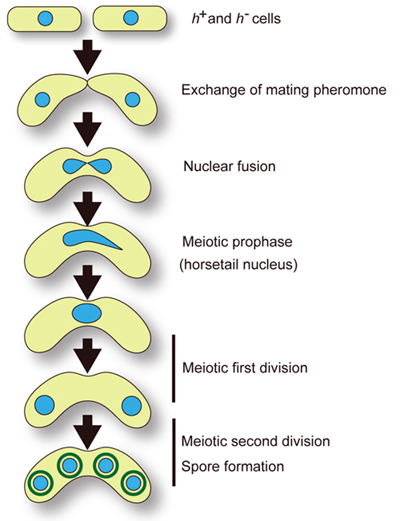 |
図2.分裂酵母の減数分裂過程 分裂酵母にはh+とh-の二種類の性(接合型)があり、栄養源が枯渇するとh+とh-の細胞が互いのフェロモンの刺激によって融合(接合)する。細胞融合に続いて細胞核の融合が起こり、ホーステール核が細胞内を往復運動する。やがて細胞核は運動を停止し、減数分裂による2回の核分裂を経て4つの胞子が形成される。 |
2.DNA複製に伴って構築されるクロマチン構造
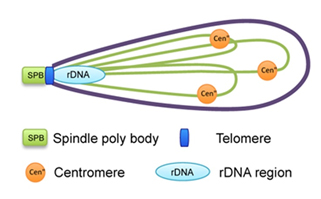 |
| 図3.減数分裂前期の分裂酵母細胞核の構造 |
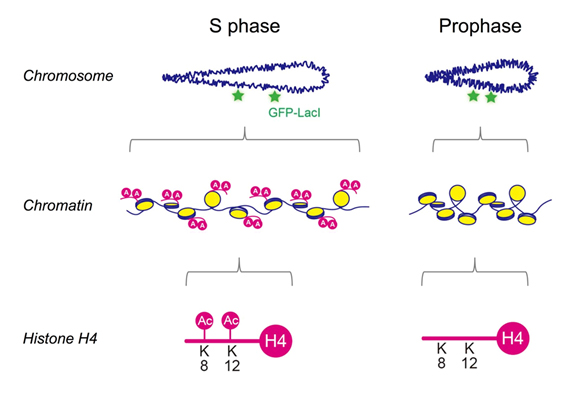 |
| 図4.減数分裂期のDNA複製でおこるクロマチン構造変化 |
真核生物染色体
私たちは、ゲノムDNAに刻まれている遺伝情報を読みとるシステムである転写機構について転写因子およびその複合体の研究を行い,生命現象の転写による制御の解明に取り組んでいます。
人の体は膨大な数、種類の細胞をつくりだし生命機能を維持していますが、これにはそれぞれの細胞が持つ核内にある遺伝子配列を必要な時に必要なだけ読みとることが重要です。この遺伝子に込められた暗号を読みとる過程を転写といいます。細胞が分裂し、分化する過程では非常に多くの遺伝情報が読みとられますが、その読みとられる量や順序などは厳密に制御されています。この転写の制御に必要なのが転写因子というタンパク質です。転写因子が作用するゲノムDNAは、核の中でクロマチン構造を作っています。そして、転写因子はクロマチンの構造変換因子やヒストン修飾酵素などと共同し、クロマチン構造を緩めたり、凝集させることにより、遺伝子の発現を調節します。我々は転写制御の分子機構と核内での動態を明らかにするために、転写複合体を精製するなどの生化学的アプローチと、生細胞でそれらの複合体を可視化する蛍光顕微鏡を用いた細胞生物学的なアプローチを試みています。
1.転写複合体の精製とクロマチン構造変換因子の同定
脂溶性のホルモンやビタミンをシグナルとして活性化される転写因子、核内レセプターはクロマチンに結合し転写を制御します。この核内レセプターが標的遺伝子の発現を制御する際に様々な翻訳後修飾を受けますが、我々はその中でもSUMO化と呼ばれる修飾を受けるときクロマチン構造変換因子 ARIP4と強く結合することを発見しました(図5)。ARIP4は核内構造体との相互作用を介して核内受容体の標的遺伝子のクロマチン状態を不活性化状態にすることで、遺伝子の過剰な発現を防ぐクロマチン構造変換因子と考えられます。現在この因子の細胞内の分子機構と生体内での機能について、ゲノムワイドな解析を進めています。
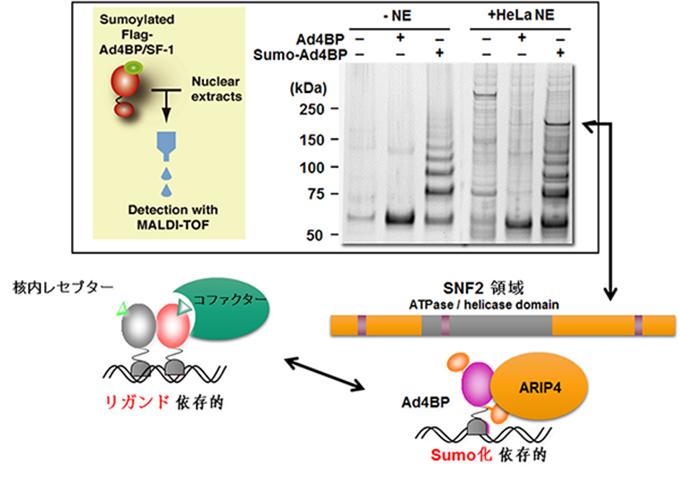
図5. SUMO化依存的に結合するSNF2ファミリータンパク質ARIP4の同定
2.ARIP4複合体の同定と機能解析
ARIP4の遺伝子欠損マウスの解析から、ARIP4は心臓の先天性疾患の原因遺伝子であることが判明しました。ARIP4の細胞内での機能が明らかになれば、この心疾患の原因解明につながると考えられます。そこでARIP4複合体の精製を行ったところ、その構成因子としてp62/SQSTM1が同定されました。p62の核内局在及び機能解析の結果、ARIP4は糖代謝経路のクロマチン構造を統合的に抑制しており、飢餓状態ではARIP4がp62を介したオートファジー経路で分解されることで恒常性維持を行っていることが明らかになりました(図6)。また、ARIP4複合体による時空間的転写制御機構を明らかにするために、生細胞内のARIP4複合体の形成とクロマチンの構造変換を可視化する系の構築を行っています。そのために核内受容体の結合配列を数百コピー直列に維持した細胞株(アレイ細胞)を樹立し、それを用いて転写因子のクロマチン結合やARIP4の複合体形成、およびその活性を観察する系を構築しています(図7)。本因子の機能の理解はクロマチン構造変換の新たな概念を明らかにするのみならず、様々なステロイドホルモンに関与する疾患や副作用の解明につながると考えています。
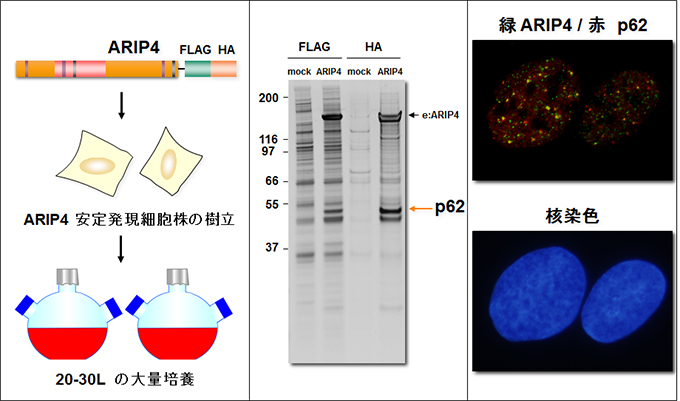
図6. ARIP4 複合体の精製と核内局在
3.外来遺伝子(DNA)の生細胞への効率的な導入方法の開発
分子細胞生物学分野において、外来遺伝子を効率よく生細胞に導入する必要があります。これまで、細胞に DNA を導入する場合、その導入効率が低いことが問題になっていました。生細胞への外来 DNA の導入効率が低い原因は、細胞内にオートファジーと呼ばれる細胞に侵入した外敵を分解するシステムがあり、そのシステムにより導入された DNA の大部分が核に運ばれる前に分解されてしまうことです。特にマウスES(胚性幹)細胞やiPS細胞では、DNA を導入しようとしてもその導入効率が悪いことが問題になっていました。 我々は細胞内分解システムの一員であるp62に着目し、p62の細胞内量を減少させることを試みました。p62を除去するとそのオートファジーの機能が弱まり、DNA が壊されなくなります。その結果、遺伝子導入効率 が上昇することを証明しました(図8)。今後、さらにp62 による外来 DNA の分解機構の詳細を明らかにし、ES 細胞やiPS 細胞の樹立に応用するとともに、生体における核酸医薬及び特定の遺伝病を治療するための遺伝子治療への応用を目指します。
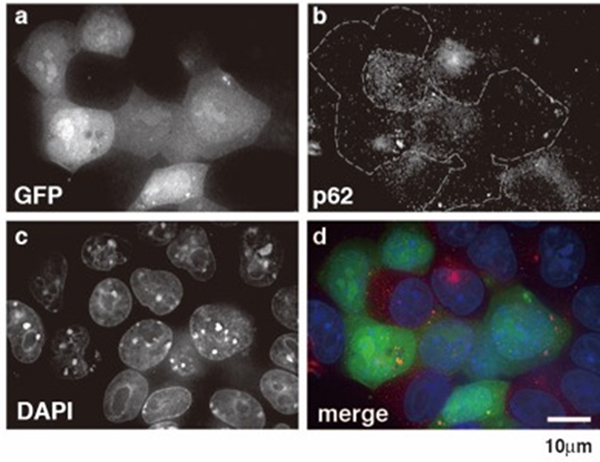
図8. p62 の発現が低下した細胞では遺伝子導入の効率が上昇する
