生命における化学反応は、均一な試験管内とは異なり、細胞小器官などの形を持った三次元空間で行われています。化学反応に加えて空間的情報を得るためには、蛍光顕微鏡を用いた高度な観察手法が必要になります。
蛍光とは、ある波長の光の照射により、異なる波長が発光することです。蛍光顕微鏡は光学顕微鏡の一種ですが、蛍光を用いると、生きた細胞の中から対象物だけを観察することができ、標的分子特異的な微細構造や動態を明らかにすることができます。
1.分解能
光学顕微鏡は、光を拡大する装置です。顕微鏡は倍率が重要であると考えている方もいるかもしれませんが、光学顕微鏡の倍率には上限がなく、いくらでも高い倍率を得ることができます。しかし、ある倍率以上にあげてもそれ以上の情報が得られなくなります。これは、光学顕微鏡には、光の波の性質に起因する分解能の限界があるからです。非常に良い顕微鏡を用いても、光の波長の約半分、250nm程度が光学顕微鏡の分解能の限界です。また、縦(z軸)方向に対する分解能はさらに悪くなります。
2.共焦点顕微鏡とデコンボルーション
蛍光顕微鏡は全方向に広がる発光を観察するので、焦点にない蛍光物質から来る「ボケ」が大きな問題になります。この問題は、1980年代に共焦点顕微鏡や、デコンボルーションなどの手法により解決されてきました。共焦点顕微鏡は、非常に小さなピンホールにより焦点面以外の光を遮断します。デコンボルーションとは、顕微鏡における点光源の広がり方を既知のパラメーターとして用い、非焦点面の光を焦点面に戻す計算手法です。最も効果的なデコンボルーション法であるconstrained iterative deconvolution(Agard 1984)の開発には、平岡が大きく寄与しました(Hiraoka, Sedat and Agard 1987)。当研究室には、共焦点顕微鏡、デコンボルーション顕微鏡があり、生細胞のタイムラプス観察などに用いています。
 |
 |
|
| 1.Delta Vision (Applied Precision Inc.) Wide-field型の蛍光顕微鏡で、長時間の生細胞観察に使用しています。Deconvolutionを行うことで、ボケのない鮮明な(Delta関数のような)画像を取得することが可能です。 |
2.ConfoCor2 LSM510META (Carl Zeiss) 共焦点レーザー顕微鏡でFRAP・FRET・FCSにより細胞内での分子のダイナミクスを観察することができます。 |
3.超解像(Super-resolution)
共焦点顕微鏡やデコンボルーションは、ボケを除く有効な手法ですが、分解能の向上は大きくありません。2000年代後半は、古典的な光学的分解能を大幅に打ち破る研究成果が相次ぎました。STED、3DSIM、PALM/STORMなど様々な方法が考案されましたが、これらの方法に共通していることは、視野内の一部の蛍光物質だけを発光させる方法を実現したことです。STED と3DSIMでは照明を、PALM/STORMでは蛍光物質を変化させました。これらの方法を用いることにより、電子顕微鏡に匹敵する分解能を蛍光により得ることができるようになりました。
当研究室には、PALM/STORMを行うことができるTotal Internal Reflection Fluorescent(TIRF)顕微鏡(写真3)、3D-SIM顕微鏡であるOMX(写真4)、などがあります。私たちは、超解像顕微鏡を用い、必要に応じて手法の改変、改良を行いながら、生体に近い状態のクロマチンの微細構造を解析しています。
 |
 |
|
| 3.全反射蛍光顕微鏡(TIRFM) (Olympus) ある角度以上で光がガラスに当たると光は全反射します。これはTotal Internal Reflection(TIR)と呼ばれる現象で、光ファイバーなどに使用される現象です。TIRF顕微鏡は、励起光をカバーグラスで全反射させ、わずかな励起光が届くカバーグラス直近(エバネッセント場)の分子だけを励起する方法です。1分子計測も可能で、PALM/STORMなどを行うこともできます。 |
4.Delta Vision OMX (Applied Precision Inc.) UCサンフランシスコのSedat labで最初に開発された3D-SIM顕微鏡をもとに製品化された顕微鏡です。TIRF機能も備え、4台のEMCCDで4色同時高速ライブイメージングにも使用できる時空間高分解能のプラットフォームです。 |
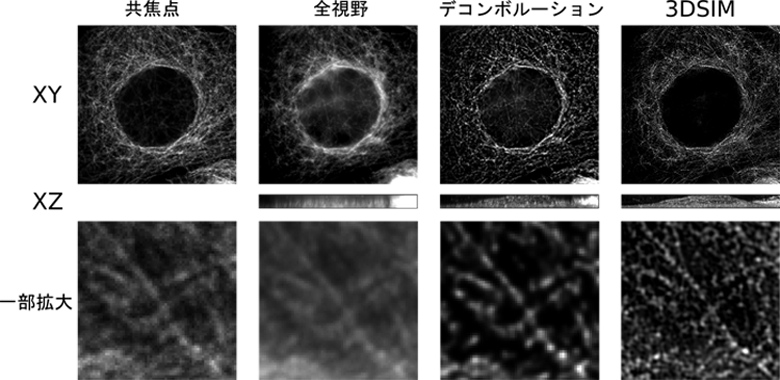
図.全視野、共焦点、デコンボルーション、3DSIMを用いた同一細胞の観察例
4.生細胞観察
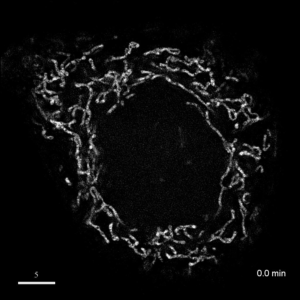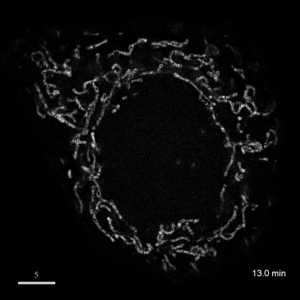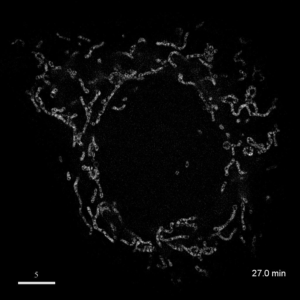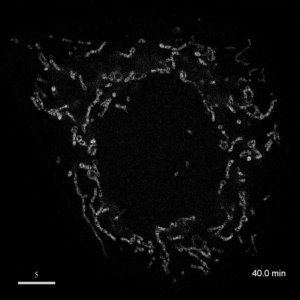
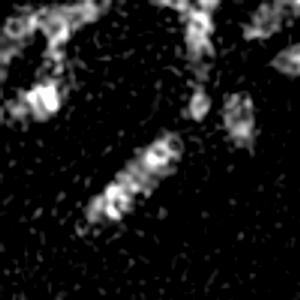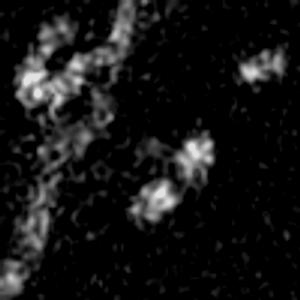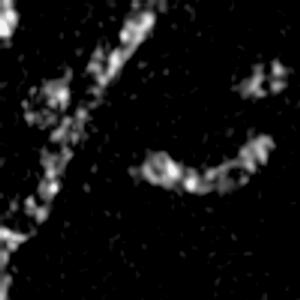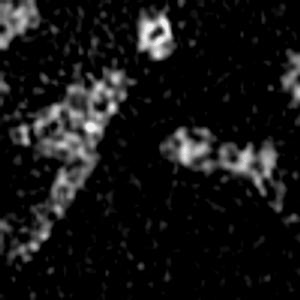
光学顕微鏡では、生きた細胞を観察することが出来ます。細胞の全体像やオルガネラの観察には、屈折率の差を利用した微分干渉顕微鏡や位相差顕微鏡が使用できますが、蛍光蛋白質を用いることで特定の蛋白質の局在や動態を可視化出来ます。しかし、蛍光を励起するための光はエネルギーを持っているため、強く光を照射すると細胞に害を与えてしまいます。そのため、細胞を生かしたまま長時間の蛍光観察をするためには、できるだけ弱い光で照射し、出てきた微弱な蛍光を捉えることが必要です。そのために、高感度CCDやEM-CCDなどを用いて蛍光画像を取得しますが、適切な実験条件を設定するためには、経験が重要です。私たちは、日々観察を行うなかで生細胞蛍光観察のノウハウを蓄積しています。また、生きた細胞で超解像レベルでの観察にもチャレンジしています。
| 3D-SIMを用いたHeLa細胞ミトコンドリアの超解像生細胞観察(1.52MB) | |
|
|
5.蛋白質動態
蛍光顕微鏡は、生きた細胞の中での蛋白質分子の動きを調べることにも使えます。蛋白質分子動態を調べる方法はいくつかありますが、蛋白質の性質や動く速さなどによって使い分けられます。
蛋白質の蛍光1分子を直接観察すると、分子の動きが分かります。しかし、細胞核内の蛋白質を1分子レベルで観察するには特殊な顕微鏡システムが必要となるほか、蛍光蛋白質の存在量を少なくする必要があります。
細胞内で自由に拡散するような非常に速く動く分子の動きは、蛍光相関分光法(FCS; fluorescence correlation spectroscopy)によって調べることが出来ます。FCSでは、数フェムトリットルという微小空間の蛍光を連続的に測定し輝度変化を解析することで、蛍光分子がその空間を通過する時間(移動の速さ)を計測できます。
生きた細胞内の蛋白質の動きは、退色後蛍光回復(FRAP; fluorescence recovery after photobleaching)と呼ばれる方法でも調べることができます。FRAPでは、蛍光蛋白質が分布する一部の領域に強いレーザ光を瞬間的に照射することで蛍光を退色させ、その領域への蛍光蛋白質の流入の速さを測定します。蛍光蛋白質の流入による蛍光の回復は、速く動く蛋白質ほど速くなります。FRAPにより、例えば、転写因子がDNAと結合する時間は数秒程度ですが、コアヒストンがDNAと結合する時間は数分から数時間にも及ぶことが分かってきました。
6.多色観察
異なる種類のタンパク質を異なる蛍光色素で色付けし、観察をすることで、それぞれのタンパク質の局在の違いや機能的関連を知ることができます。ところが、異なる色で染色されたまったく同じ構造を、レンズを通して
観察すると、色ずれして観察されてしまいます。このようなレンズの性質に起因する色ずれは「色収差」と呼ばれ、多色観察をする上で非常に厄介な問題です。一方で、近年の高度な蛍光顕微鏡は複数台のカメ
ラを用いて、高速かつ同時に異なる色の画像を取得するものがあります。このような顕微鏡ではカメラ間の物理的な位置ずれが、先程のレンズの性質とは別に色ずれの原因となります。超解像顕微鏡のような非常に高
い分解能を持った顕微鏡を用いた観察の場合、色ずれの問題は特に注意が必要で、色ずれを考慮していないと、本来は共局在しているタンパク質を「共局在しない」と間違えて結論してしまう可能性があります(下図、
補正前)。
我々はこのような色ずれを高精度に補正するソフトウエア「Chromagnon」を開発しました(Matsuda A. et. al., Sci. Rep.,8(1):7583(2018))。このソフトウエアでは、観察対象の生体試料により引き起こされる
色収差も計測し補正することで、従来の約十倍となる20nm以下の精度で色ずれを補正することが可能です(下図、補正後)。これまでの類似のソフトウエアでは、人工的な校正用サンプルの色収差を計測し、その色収
差を補正していたため、観察対象の生体試料により引き起こされる色収差を補正できませんでした。
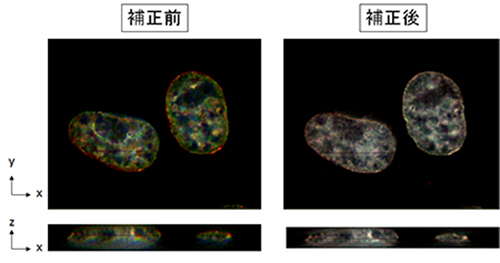 |
図.多色観察における色ずれ HeLa細胞のDNAをDAPIで染色し、青、緑、赤の各チャネルで観察した(左、補正前)。これをChromagnonを用いて色ずれを補正した(右、補正後)。上はxy平面の色ずれ、下はz方向の 色ずれの程度を示している。 |
このソフトウエアはオープンソースのソフトとして公開しています。ご興味をお持ちの方はこちらからダウンロードしてお使いください。
7.まとめ
顕微鏡技術には光学の知識だけでなく、物理、数学、化学、生物、量子力学、コンピューターサイエンスなど、様々な知識が必要となります。当研究室には、正しい顕微鏡知識を得るにとどまらず、既存の方法では不可能な顕微鏡技術を開発する知識や設備が揃っています。
