1分子を見て、つかまえる
岡田 日本学士院賞恩賜賞の受賞、おめでとうございます。
柳田 どうもありがとうございます。
岡田 今日は、まず受賞の対象となったお仕事について、かいつまんでお話をしていただけませんでしょうか。
柳田 簡単に言うと1分子を観察操作する方法
(注1)
を開発して、分子モーターとしてのたんぱく質の機能を調べた研究が受賞対象なんですが、僕は学生の頃、電気工学科にいましてトランジスタの基になる半導体素子を……。
岡田 それはいつ頃ですか。
柳田 マスターにいたのが70年、71年頃です。
岡田 華やかな頃ですね。
柳田 半導体産業を日本の基盤産業にしようということで、当時一番華やかな分野でしたね。それが、なぜ生物に移ったかということですけど (笑)、一応半導体の原理というのはすでに明らかになっていまして、あとはコンピュータとして使えるものにどのようにしてゆくかとか、応用研究になっていまして、僕としてはもうちょっとベーシックなものをやりたいと思ったんです。
岡田 それで、生物物理の大沢先生のところへ行かれた。
柳田 実は大沢先生のこともあまり知らなかったんです。ただ、物理の人で生物をやっている。じゃあ行きましょうということで。でも、オーバードクターが多くて、ドクターでも就職はできない。
岡田 そういう問題がずいぶんあった時代でしたね。
柳田 大沢先生がいわれた言葉で一番印象に残っているのも、うちはオーバードクターが20数名いる。キミは20数番目だと、それでもいいなら来なさい、でした。就職はほとんど絶望的だったんですね。
岡田 それでよくふんぎられましたね。
柳田 電気の先生には大見栄きって来てますからね。でも、大沢先生は2ヵ月たっても研究テーマとか何もおっしゃらない。ある日、先生何をしたらよいでしょうと聞いたら、キミは何かしたいから来たんでしょうといわれて。あとで聞いたら、大沢牧場
(注2)
といいまして、何も指導しない先生で有名だったんです。
岡田 へえ、そうなんですか。
柳田 しょうがないから、それまでずっと光を使った計測をやっていましたので、そういう計測技術とたんぱく質がぎっしりつまって一番測りやすい筋肉の細胞を組み合わせて研究を始めたんですけど、ちょうど筋肉の分野ではハックスレーという人の首振り説で終わりだ、解明できたといわれてまして。大沢研でももう筋肉はやめて違うことをやっていたんです。何をいまさらといわれました。
岡田 それでも、始められた。何を思って始められたんですか。
柳田 僕とかトランジスタの研究をしていた者にすると、首振り説はやっぱり変なんですよ。というのは、たんぱく質は使うエネルギーがトランジスタの数千倍少ない。ものすごく少ないエネルギーで動いているんですよ。それで、スピードはミリ秒くらいで百万分の1くらい遅い。だから、ドランジスタと同じ仕組みで働いているとすると、たんぱく質は非常に性能の悪い素子ということになっています。
岡田 そうですね。
柳田 なのに首振り説は、ある意味でトランジスタと同じ考え方で0と1、鍵と鍵穴式になっていて、化学反応と力学反応、入力と出力が1対1できちっと対応している。これは面白くない (笑)。
岡田 すごいなあ。そのときにそう思われたわけですか。
柳田 生物が人工機械の素子と同じような仕組みで動いているわけがない。それは大沢先生もおっしゃっていました。それで、首振り説を否定してやろうと思ったんですね。まだミステリーがあるに違いないと。筋肉を動かすミオシンというたんぱく質の頭に蛍光分子をつけて測ってみると、筋収縮中にハックスレーがいっているような大きな構造変化は起こらなかった。それを論文に書いたら、ある国際学会に呼ばれてえらい受けました。でも、全面的に間違いだといったわけじゃなくて、僕が一番興味があったのはたんぱく質は1対1できちっと対応してまったく自由度がないんじゃなくて、ある状況に応じて対応するはずだ。それくらいの高次機能があると…..。
岡田 効率が悪いだけじゃなくて。
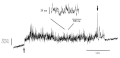
柳田 あいまいなシグナル、遅いシグナルになんか意味があるに違いない。じゃあ、きちっと調べよう。1分子でやろう。1分子でやるためには見ないといかん。生きたままのたんぱく分子をとにかく見ようということになったんです。まあ、可視光で見えないほど小さくても夜空で星を見るのと同じ原理で、真っ暗闇で光ってりゃ見えるだろうと。それで、1984年に始めてアクチンというたんぱく分子を見たんですけど、固いとみんな思っていたアクチンがすごくしなやかだった。
(注3)
岡田 生き物みたいにアクチンが走っているのは、僕もびっくりしたなあ。見せてもたったとき。ほんとになんか生き物やと思いましたね。ミオシンをシートにしてというのはうまい方法だなと思いました。あれはすぐにそういう工夫ができたんですか。
柳田 そうですね。とにかく筋肉の中で起こっている運動を顕微鏡下で再現したかったんです。そのとき始めて「ネイチャー」に出したんですけど、非常にうまくいった研究の一つでしたね。化学量と力学量がそんなにきちっと対応していないことがわかって、その次は見ているだけじゃなくて、細いガラス針でつかまえようということになりました。
岡田 それもびっくりしたんや。そのアイデアもすっと出てきたんですか。
柳田 そうですね。結局、2年ほどかかりましたけどね。学生にもよく言うんですよ、人間の学習能力はすごいと。2年間くらい論文も書かないで。それだけを訓練した人じゃないとできないんですよ。
(注4)
たんぱく質には個性がある
岡田 僕が研究者になった頃、生物物理というのは言葉としては盛んでした。だけど、なんとのう言葉だけがかっこいいと思ってたんです。それが先生のお仕事で、ほんとの意味の生物物理が生まれたなあと感じて、現実味をもちました。
柳田 そういっていただくとありがたいんですけど。とにかく、そういうふうに分子をつかまえて、力を測ることができるようになりました。
岡田 やってみようと思われたのがたいしたものですね。
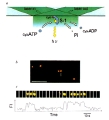
柳田 その後は、教授になって研究室もスケールアップしたので、化学反応を見ようということになって。生体の中でエネルギーを運んでいるATP (アデノシン三リン酸)が分解しているところを水の中で直接見ることができました。そして1分子の力学反応と化学反応を同時に測定できるようになりました。
(注5)
すごく面白いと思ったのは化学反応と力学反応はきちっと対応しているんじゃなくて、ATPが分解されて1秒くらいたっても仕事をするという、メモリー機能を持っていたんです。
岡田 それは、どこで貯蔵していることになるんですか。構造が少し変化するようなことがありますか。
柳田 今まではたんぱく質はアミノ酸配列が決まるとユニークに三次構造も一つに決まると考えられてきました。ところが、どうも複数の準安定な状態をとるらしいのです。この準安定状態にエネルギーを貯蔵している。また、ある意味では、同じたんぱく質でも一つひとつ個性があることを意味しています。結局、たんぱく質は一つで動いているわけじゃないので、集合体として一番都合のよいように、こんな環境ではこういう状態というように非常に柔軟性があるんじゃないかと思いますね。
岡田 そうですね。なんか水との関係でいうと、熱運動との対応になると思うけど、どうも生き物というのはそれをうまく利用しているようですね。
柳田 おっしゃるとおりで、最終的にはATPの分解エネルギーを使って帳尻合わせをするんでしょうけど、各ステップは熱で十分動かせる程度の…..。
岡田 柔軟性をもっているんでしょうね。
柳田 そうですね。自発的に動けるということが大切で、たんぱく質は水の温度のちょっとした変化ぐらいでも自分自身が変わるくらいセンシティブなんですね。エネルギーレベルが低いんです。
岡田 エネルギーレベルとしては熱と同じレベルになるんですな。
柳田 トランジスタは温度が変わろうと変わるまいと、0と1をきちっと出すようになっていますけどね。
岡田 高分子という意味合いのところでも何かありそうですね。
柳田 そうだと思います。なぜたんぱく質はでかいのか。やっぱりそれだけ機能がついてくるんでしょうね。
岡田 ずいぶん多様なものを持っているわけですね。まだ、これからもやることがだいぶあるようですね (笑)。
柳田 そう。学生には今までは力仕事、筋肉仕事だったけれど、これからは頭を使わなきゃいかん、ブレイン・リサーチやといってるんですけど。
ノイズとは仲良くしている
柳田 僕は最近思うんですよ、脳より細胞の方が高級じゃないかと (笑)。
岡田 脳の方がシンプルだと。
柳田 そうですね。細胞の中の情報処理はほんとに難しい。いま研究室の3分の1くらいをあてて情報伝達を1分子でイメージングする研究をしています。
岡田 僕が脳で一番気になるのは、一つの脳細胞にたくさんシナプスがあるわけですよね。あれだけあれば、シグナルそのものはデジタル型なんでしょうけど、それを全体として処理するためには、なんかアナログ型で処理せんことには、これとても時間がかかってしょうがないと思うんですが。
柳田 それが今のメインテーマなんでしょうけど、神経細胞はミリ秒で情報を送っていてコンピュータの100万分の1くらいのスピードです。遅いんですよ。また、1万回に1回は間違える。コンピュータは10の80乗分の1しか間違えませんから、比べるともうどうしようもないシグナルを送っているように見えるんですね。だから、0と1のシグナルだと破綻してしまう。僕もいずれは脳とコンピュータの違いを研究したいんですが…...。
岡田 その遅さに意味がある。
柳田 そうですね。水の情報とかわけのわからない相互作用で仕事をするんだけど、ある情報処理はもうできちゃっているんでしょうね。かなりの情報を持ったシグナルになっているんじゃないかと思います。
岡田 そうですか。
柳田 ええ。だから、そこを解明したい。
岡田 どうも情報伝達のノイズを消すためにたくさん使っていると思ったりして。
柳田 コンピュータのレベルからすると、ノイズから逃げるというのはたぶんもう諦めているでしょうね。
岡田 生物では…。
柳田 無理だと思うんですよ。
岡田 それは面白いな。
柳田 ノイズから逃げようと数千倍のエネルギーをつぎこむと、もう脳なんで溶けちゃうくらい温度が高くなってしまいますよね。むしろ、ノイズとは仲良くしている。ノイズレベルで自分が変わるということは、たとえば先生と僕が分子としますと、水を通して先生がそこにいるというだけで僕はもう変わるんです (笑)。よく言うんですけど、細胞の中でシグナルに対応して100個くらいのリセプターが働いてシグナルを送る。ある人は一つじゃノイジーだから、100個集めてノイズをなくすと考える。僕はそれは間違いだと思います。100人頭のいいのがいて、それの結果としてシグナルを送り出す。一つひとつはすごく賢いんだと。一人でも仕事はできるんだけど、100人集まって仕事をしている。細胞でも一つひとつは個体をつくる情報をみんな持っているんだけど、たとえば皮膚の細胞に甘んじるわけですよね。そういう意味では非常に余裕があるんじゃないかと。
岡田 そういうことでしょうね。たしかに自動車の部品とは違いますよね。
柳田 違いますね。普通ロボットをつくるときはモーター二つくらいで関節を動かす。筋肉では、全部モーターなんです (笑)。数千兆個モーターを入れて、非常に贅沢なつくりなんです。
岡田 先生のお話しを聞いていると、やることがいっぱいありすぎますね。今日はどうもお忙しいところ、ありがとうございました。