グリシンの場合-01
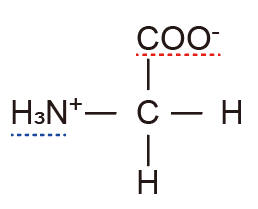
グリシンは残基に水素イオンを有するアミノ酸です.

側鎖はイオン化せず,アミノ基,カルボキシル基のみがイオン化する可能性があります.
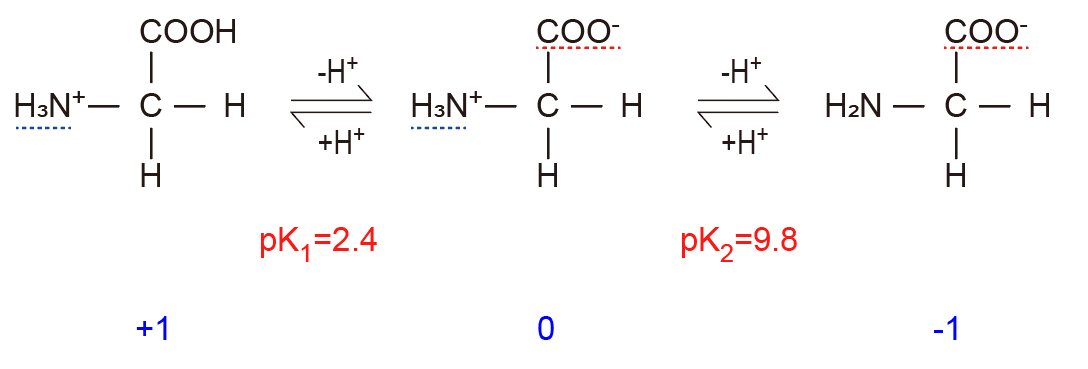
二つの等電点は,
pK (α-COOH):2.4
pK (α-NH3+):9.8
です.
ここでは,二つの方法で解いていきましょう.
平衡反応
グリシンは三つの平衡状態をとると考えられます.
N+RC N+RC- NRC-
A B C
アミノ基のイオン化,カルボキシル基のイオン化により三つ状態,電荷は+1,0,-1と取ります.
その際の平衡定数は,pK値から計算できます.
また,簡便に,N+RC,N+RC-,NRC-,もしくは,A, B, Cとおきましょう.
各反応の平衡定数は,
\(\Large K_1 = \frac{N^+ R C^- \cdot H^+}{N^+ R C} = \frac{B \cdot H}{A} \)
\(\Large K_2 = \frac{N R C^- \cdot H^+}{N^+ R C^-} = \frac{C \cdot H}{B} \)
となります,従って,
\(\Large A = \frac{B \cdot H}{K_1} = \frac{C \cdot H^2}{K_1 K_2} \)
\(\Large B = \frac{C \cdot H}{K_2} \)
とCで置き換えることができます.
また,
\(\Large A + B + C = 1 \)
となりますので,
\(\Large \frac{C \cdot H^2}{K_1 K_2} + \frac{C \cdot H}{K_2} + C = 1 \)
とすることができ,
\(\Large C = \frac{1}{\frac{ H^2}{K_1 K_2} + \frac{ H}{K_2} +1} \)
\(\Large B = \frac{H}{K_2} \frac{1}{\frac{ H^2}{K_1 K_2} + \frac{ H}{K_2} +1} \)
\(\Large A = \frac{H^2}{K_1 K_2} \frac{1}{\frac{ H^2}{K_1 K_2} + \frac{ H}{K_2} +1} \)
と書き換えることができます.
電荷
ここで電荷が0になるには,
A:+1 B:0 C:-1
であるから,A=C となればいいので,
\(\Large \frac{H^2}{K_1 K_2} \frac{1}{\frac{ H^2}{K_1 K_2} + \frac{ H}{K_2} +1} = \frac{1}{\frac{ H^2}{K_1 K_2} + \frac{ H}{K_2} +1} \)
となり,共通の分母はキャンセルし合って,
\(\Large \frac{H^2}{K_1 K_2} = 1 \)
\(\Large H^2 = K_1 K_2 \)
\(\Large - ln (H^2) = - ln (K_1 K_2) \)
\(\Large 2 (- ln H ) = - ln (K_1)-ln( K_2) \)
\(\Large 2 pH = pK_1 + pK_2 \)
\(\Large pH = \frac{pK_1 + pK_2}{2} =\frac{2.4+9.8}{2} =6.1\)
とふたつのpKの平均となります.
次に,独立にそれぞれの基の解離を考えていきましょう.