Top > 研究プロジェクト > 走電性の分子メカニズム
走電性の分子メカニズム
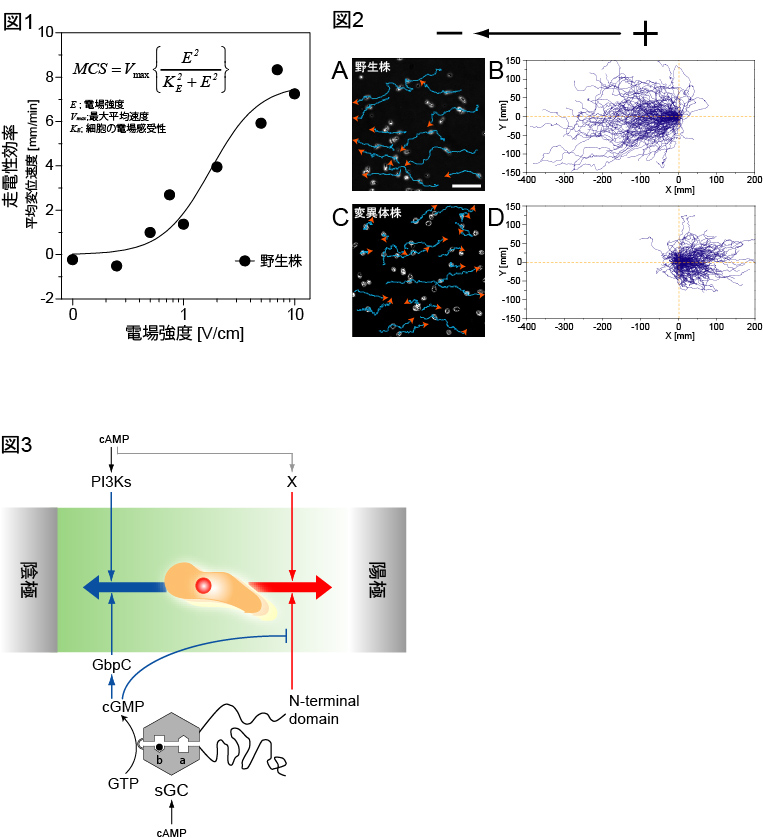
外部刺激に対する細胞の応答には、集団平均では見えてこない個々の細胞ごとのばらつきが存在します。これは細胞の応答が単に外部刺激の影響を受けるだけでなく、細胞内情報伝達ネットワークの状態に依存しているためであると考えられます。そこで、このような細胞内情報処理過程を研究するためには、細胞内情報伝達ネットワークの状態をモニターしながら、高精度に制御された入力刺激に対する細胞の応答を一細胞ごとに定量的に計測することが必要となります。入力の精度が高ければ高いほど、細胞内情報処理システムの状態を反映した応答を定量的に計測することができるため、入力刺激の厳密な制御は細胞内情報伝達の仕組みを調べる上で重要です。こうした高精度の入力刺激の制御が容易な手法として、電気シグナルの利用が考えられます。実際、様々な細胞は電位勾配を認識して方向性のある運動を示す走電性 (electrotaxis, galvanotaxis)と呼ばれる性質を持っています。そこで、制御された入力刺激として電場を用い、応答として細胞運動を計測することで、上記要請に適う系を構築可能です。本研究は高速かつ低ノイズで電位勾配を発生させることができる実験系を開発し、走電性応答における入出力関係を明らかにしました(図1)1)。また、このような入出力関係を実現するメカニズムを明らかにするために、走電性応答に関与している複数の細胞内情報伝達経路を同定し、これらの経路が走電性応答における細胞の運動方向を決定することを明らかにしました(図2, 3)2)。
(図の解説)
走化性研究のモデル生物である細胞性粘菌Dictyostelium discoideumは直流電場下で陰極側へ移動運動します(動画1)。
電位勾配の大きさ(入力)と走電性効率(出力)の関係を明らかにするために、細胞の陰極側への移動運動を陰極方向への
平均変位速度により定量化した結果、平均変位速度は電位勾配の大きさE に対してシグモイダルに変化し、その入出力関係
は現象論的方程式で記述できることがわかりました(図1)。(図2)野生株は陰極側へ移動運動するのに対して、cGMP経路
に変異をもつKI変異体株は陽極側へ向かいます(動画2)。変異体や阻害剤を用いた実験から、走電性応答に関与するシグナ
ル伝達経路が明らかになりました(図3)。動画のスケールは50μm、タイムスタンプは分:秒。
| 動画1(野生株):mov | 動画2(KI変異体株):mov |
参考文献
1) MJ. Sato, M. Ueda, H. Takagi, TM. Watanabe, T. Yanagida, M. Ueda “Input-output relationship in galvanotactic response of Dictyostelium cells” Biosystems 88, pp261-272. (2007).
2) MJ. Sato, H. Kuwayama, W. van Egmond, A.L.K. Takayama, H. Takagi, P. van Haastert, T. Yanagida, M. Ueda “Switching direction in electric-signal-induced cell migration by cyclic guanosine monophosphate and phosphatidylinositol signaling” PNAS 106, pp6667-6672 (2009).
