Top > 研究プロジェクト > 細胞内1分子イメージング解析法の開発
細胞内1分子イメージング解析法の開発
細胞内1分子顕微鏡の開発
はじめに
タンパク質などの生体分子1個を水溶液中で可視化し,それらが働く様子を実時間観察する技術を1分子イメージング法 (single-molecule imaging techniques)とよぶ。1995年に柳田運動子ERATOプロジェクトにおいて、船津高志氏(現在、 東京大学)らによって世界に先駆けて開発され、分子モーターや酵素などの動作機構に関する新たな知見が数多く得られ てきた1-2)。また、この技術を細胞生物学・医学研究へと応用するために、1998年頃から生きた細胞の中で生体分子1個 をイメージングする顕微鏡技術の開発が進められた。当時、大阪大学・医学系研究科におられた佐甲靖志氏(現理化学研 究所)を中心として、顕微鏡光学部品、細胞調整法を見直すことにより、2000年頃に細胞内1分子イメージング法を確立 した3-6)。これにより、生理活性物質リガンドが細胞へ結合する様子や情報伝達分子の二量体化、複合体形成、リン酸化、 拡散、構造変化などの細胞内シグナル伝達の素過程を生きた細胞内において1分子レベルで可視化することが可能になった。 電子顕微鏡を用いた観察では、細胞を生きたまま観察することが出来ないが、細胞内1分子イメージング法では、生きた 細胞内で分子本来の挙動を分子1個ずつ観察することができる。
1分子計測法の利点
生体分子の特性を調べる一般的な方法では、多数の分子の集団的挙動が計測されている。このため、計測によって得られる 特性は、分子集団として平均化されたものになる。一方、1分子計測法では、分子の特性を1個ずつ計測するために、その 分子集団の平均的挙動が分かるだけでなく、分子ごとの確率的な振るまいや集団としてのバリエーション・ゆらぎの情報が 得られる。また、分子の反応過程を追跡する場合、従来の方法では多数の分子集団の反応を何らかの工夫により同調化させ る必要があるが、これは一般的に言って簡単ではない。ところが、1分子計測では、分子反応の開始点から終了点までの時 系列データーを1分子ごとに得られるために、多数の分子を同調化させることなく、反応過程に関する情報を得ることがで きる。さらに1分子計測では、観察対象の生体分子を必ずしも分離精製する必要はなく、生きた細胞の中で、その特性を調 べることができる。細胞は均一な袋ではなく、内部に複雑な構造をもつために、個々の分子にとっては、まわりの微小環境 が少しずつ異なっている。細胞内1分子イメージング法では、生体分子の特性を微小環境の違いや細胞状態の変化と対応づ けて計測することができる。分子集団を扱う従来の手法では得ることが出来なかったような分子ごとの反応過程の違いが見 つかってきており、細胞の振る舞いを理解する上で重要な知見が得られてきている。細胞内1分子イメージング法は情報処 理研究に対して新たな手段を与えると共に,生物の情報処理の巧みさや不思議を露わにする魅力的な技術である。
全反射蛍光顕微鏡法
細胞内1分子イメージングには全反射蛍光顕微鏡法(Total internal reflection fluorescence microcopy (TIRFM))がよ く用いられる。この顕微鏡法は、ガラスと試料との界面で形成されるエバネッセント光を利用することでガラス近傍の蛍光 分子を1分子レベルで観察することができる顕微鏡法である7)。図1に示したように、光がガラス側から入射すると、ガラ スと試料の屈折率に応じて屈折し、試料側に放射される(スネルの法則)。この放射は入射光の角度( )が比較的小さい場合 におこるが、ある臨界角以上で入射した場合には、光はガラスと試料との界面で全反射し、試料側へ放射されない。このとき ,界面には入射光による振動電場が形成されるが、これがエバネッセント光と呼ばれる。エバネッセント光の進行方向は反 射面に対して平行な向きとなり,垂直方向には伝搬しないため、その光強度が反射面から垂直方向に離れるに従って指数関 数的に急激に減衰する性質をもつ。その性質を利用することで、試料のガラス近傍のみを照明することができる。試料中に 蛍光色素があると、ガラス近傍にある蛍光色素のみが励起され、ガラス表面から離れたところにある蛍光色素は光らないた めに、真っ暗の背景の中でガラス近傍の色素だけが蛍光を発することになる。ちょうど夜空で星が光っているところを想像 していただくとよい。背景光がほとんど無いために、蛍光分子1個が発する微弱な蛍光シグナルでも十分に可視化することが できる。
全反射蛍光顕微鏡法には主にプリズム型と対物レンズ型の2種類があり、目的に応じて使い分けられる。プリズム型TIRFM は背景光をできるだけ減らしたい場合や、1分子蛍光分光、1分子FRET、高精度力学測定との同時計測など、複雑な光学系に 組み込む場合によく用いられる。対物レンズ型TIRFMは試料の厚みに制限がなく、ガラスに接した面を観察することができため、 生細胞などの厚みのある試料の観察に用いられる。また、試料の上側が空いているためマイクロインジェクションやマニュピ レーション、電気生理学的手法などと組み合わせることが比較的容易である。実際、対物レンズ型TIRFMは生体分子1個を捉 まえて操作するナノマニュピレーション技術と蛍光1分子イメージング技術を組み合わせるために、徳永万喜洋氏(現在、国 立遺伝学研究所)らによって開発された8)。細胞内1分子イメージングには対物レンズ型TIRFMが良く用いられている。
現在の開発事項
細胞内1分子顕微鏡装置の設定や画像データー処理には、多くの人手を要するため、信頼できるデーターを得るのに多くの時 間がかかっている。我々のグループでは7種類のシグナル分子について解析を進めているが、走化性情報処理システムの全貌 を明らかにするには、20種類程度について解析を進める必要があり、現在の解析速度では絶望的である。さらに、細胞内1 分子顕微鏡法は開発されて10年近く経つが、現在でも実験者の職人的技術と解析のための専門的知識が必要とされており、 新規に1分子研究を始めようとされる方々にとって大きなバリアとなっている。細胞内のシグナル伝達の解明に資する計測技 術にするため、さらには、生命科学に真に実用たらしめる計測技術にするためには、顕微鏡による画像データーの取得とその 後の解析過程を徹底的に自動化し、ハイスループット化する必要がある。そこで、我々のグループではCRESTプロジェクトにお いて、細胞内1分子顕微鏡の自動化および画像データーの解析ソフト開発を行っている。また、得られた1分子の運動軌跡のデ ーターから分子の確率的特性(拡散係数、反応速度パラメータなど)を統計的に解析する手法の開発を行っている。
拡散・キネティクス統計解析法の開発
細胞内情報処理システムのダイナミクスを解明するためには、情報伝達反応のキネティクスが細胞膜上で時間・空間的に
どのように制御されているのかを明らかにする必要があります。1分子イメージング技術を用いることで、シグナル分子
の情報処理特性を規定する時空間パラメータである細胞膜滞在時間(解離速度定数)や2次元拡散係数を、生きた細胞に
おいて細胞膜上の位置や入力刺激と関連づけて解析できます。特に、拡散運動性に関しては、同一分子集団においてもそ
の違いにより区別できる多状態が存在することがこれまでの観察から示唆されており、各状態が情報伝達の各反応段階を
反映している可能性があります。そこで、状態間の遷移キネティクスを推定するために、分子の拡散運動の時系列変化に
対する統計解析法を開発しています。
これまでに、分子が単位時間あたりに示す変位に関する統計理論を導入したことで、1分子の軌跡からの拡散係数の推定を
より精度よくできるようになり、拡散係数の異なる状態数の推定を統計科学的な指標(AIC, 赤池情報量基準)を参照して
行うことが可能となりました9)。また、変位時系列の自己相関解析によって状態間遷移を検出する方法を確立し、遷移反応
を含めた2次元拡散方程式に基づいて、1分子軌跡の統計データからキネティックパラメータの推定を行えるようにしました。
これらの一連の解析は自動解析プログラムによって行うことができるようになっています。数値シミュレーションによって
生成された軌跡を用いた予備的な解析結果より、1分子の軌跡を数百~数千個程度用いれば十分に高い精度でパラメータ
推定が可能であることがわかっています。
現在、各軌跡において、ある時間にその分子がどの状態をとっているかを、隠れマルコフモデルを用いて推定しようとして
います。隠れマルコフモデルは音声認識やDNA塩基配列解析において頻繁に使われる統計モデルです11)。拡散係数や遷移
レートなどのモデルパラメータはもとより、確率的に最も起こりうる状態時系列の推定が可能です。状態遷移を伴う拡散
運動のシミュレーション時系列に対して推定を行った結果、1分子の拡散運動に対しても、隠れマルコフモデルに基づいた
状態推定は十分な推定力を有することを確認しています。今後は、これらの解析手法を1分子輝点自動追跡ソフトへ組み込
み、画像取得から反応スキームおよび拡散・キネティックパラメータの推定、軌跡への状態割り当てまでを自動で行う顕微
鏡システムの構築を目指しています。
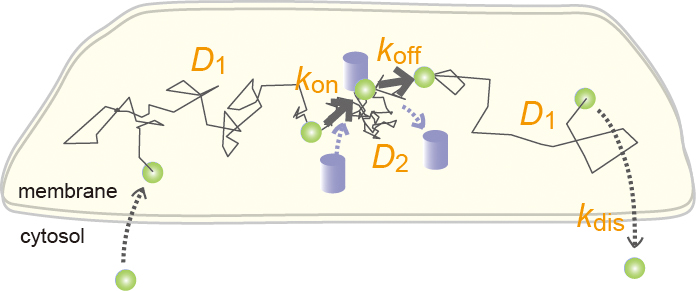
図 拡散運動性が経時変化を示す分子のキネティクス推定。1分子の細胞膜上での拡散運動の軌跡において、 拡散係数(D1, D2)が異なる多状態間を遷移し細胞膜から解離するときの各パラメータを統計的に推定する方法 を開発しています
1分子粒度シミュレーション法の開発
理化学研究所・基幹研究所・先端計算科学研究領域・システム計算生物学研究グループ・生化学シミュレーション研究チー ム(チームリーダー:高橋恒一氏)との共同研究により、1分子イメージング法によって得られた計測データーに基づいた 1分子粒度細胞シミュレーション法の開発を行っている。
参考文献
1) T. Funatsu, Y. Harada, M. Tokunaga, K. Saito and T. Yanagida : Nature 374, 555 (1995).
2) Y. Ishii, A. Ishijima and T. Yanagida : Trends Biotechnol. 19, 211 (2001).
3) Y. Sako, S. Minoghchi and T. Yanagida : Nat. Cell Biol. 2, 168 (2000).
4) Y. Sako, K. Hibino, T. Miyauchi, Y. Miyamoto, M. Ueda and T. Yanagida : Single Mol. 1, 159 (2000).
5) M. Ueda, Y. Sako, T. Tanaka, P. Devreotes and T. Yanagida: Science 294, 864 (2001)
6) Y. Sako and T. Yanagida : Nat. Rev. Mol. Cell Biol. Suppl, SS1 (2003).
7) T. Wazawa and M. Ueda: Advances in Biochemical Engineering/Biotechnology. Microscopy Techniques. (Jens Rietdorf, ed.) SpringerVerlag, Special Volume 95, 78 (2005).
8) M. Tokunaga, K. Kitamura, K. Saito, A. H. Iwane and T. Yanagida : Biochem. Biophys. Res. Commun. 235, 47 (1997).
9) Matsuoka, S., Shibata, T. and Ueda, M. (2009). Biophys. J. 97: 1115-1124.
10) Takahashi K, Tanase-Nicola S, ten Wolde PR. (2010) Proc Natl Acad Sci U S A. 107: 2473-2478.
11) Bronson JE, Fei J, Hofman JM, Gonzalez RL Jr, Wiggins CH. (2009) Biophys. J. 97(12):3196-3205.
