電気・光学的電気的同時計測装置の概要と実験方法
|
近年の光学顕微鏡法の著しい進歩によって、蛍光分子1分子を観察することが可能になり、これらの方法を用いて、種々の蛋白質、あるいは核酸分子1分子の直接観察が行われています。これらの方法は生きた細胞中の情報伝達分子系の解析等にも利用され始めており「1分子生理学」と呼べる分野が形成されつつあります。
ところが、タンパクの「1分子計測」は新しいものではなく、チャネル蛋白の研究においては、光学的1分子計測法の開発より40年近くも前から行われてきました。つまり、今から40年以上前に、単一チャネル記録法が開発され、チャネル蛋白1分子を透過するイオン電流が計測されたのが、初のタンパク質「1分子計測」だったのです。勿論、パッチクランプ等の単一チャネル電流記録法は、チャネル蛋白の構造変化を直視するものではなく、構造変化を膨大な数のイオンの流れに「増幅」し検出するものですが、蛋白分子「1分子」の挙動を実時間で捉えたという点においては、まさに1分子計測法の先駆けであると言えます。
パッチクランプ法や脂質平面膜法による単一チャネル電流記録法は、今や一般的な方法となり、市販の装置を組み合わせることにより、比較的容易にチャネル蛋白1分子の挙動を観察することが可能です。これら単一チャネル電流記録法と、前述の光学顕微鏡による1分子計測法を組み合わせることが出来れば、チャネル蛋白のゲーティングに伴う構造変化や、薬物や制御蛋白との相互作用等を1分子レベルで直視することが可能となり、生物物理学的、生理学的に大変強力な手段と成り得るでしょう。このような理由で、光学的1分子計測法が開発された当初より、単一チャネル蛋白の電気・光学的同時計測系の開発は強く求められ、装置に関する多くのアイディアが提出されてきました。ここでは、私達が開発した人工脂質平面膜法と光学顕微鏡の組み合わせによる、単一チャネル分子の電流・蛍光同時計測実験系の紹介を行います。
私達が、この実験法を開発してから既に10年経ちますが、未だに発展途上の技術で、文字通り「日々」改良を重ねております。
|
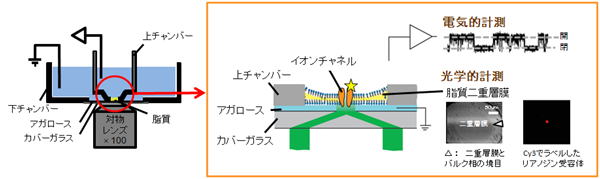
1分子チャネル分子の電気的・光学的同時計測装置は、全反射顕微鏡による1分子イメージング技術と脂質平面膜法による単一チャネル電流記録法から構成されています。全反射顕微鏡は、蛍光標識した単一分子を観察することができる顕微鏡です(①)。脂質平面膜法は、単一チャネル電流を測定する一般的な方法です(②)。これらを組み合わせることで、チャネル蛋白の構造変化と機能変化を同時に計測することができます。
1,顕微鏡
一般の生物顕微鏡を用いても、強い光源(レーザー光源等)と感度のよいカメラがあ れば、比較的簡単に蛍光1分子を観察できます。1分子蛍光観察に於いて最も注意を要するのは、背景光の除去ですが、水溶性蛋白と異なり、我々が対象としているチャネル蛋白の並進運動は膜内に限定されているので、水溶液相に浮遊している蛋白からの背景ノイズを考慮する必要がありません。よって、落射照明でも十分に1分子の観察が可能です。もちろん、蛍光分子が溶液中にも存在する場合、例えば、チャネル蛋白と蛍光性リガンドとの相互作用を観測する場合などには、溶液中の蛍光色素からの背景光を抑える工夫が必要です。このために、私達は、いわゆる対物レンズ型の全反射顕微鏡(TIRFM:
Total Internal Reflection Fluorescence Microscope)を用いています。
2,脂質平面膜法 。
単一チャネル電流記録は、脂質平面膜法を用いて行います。この方法では、人工膜をポリプロピレン等のプラスティックシート上に開けた細孔(直径100-200μm)に形成させ、そこにチャネル蛋白を含むリポソームを融合させることで、チャネル蛋白を人工膜に組み込みます。そして組み込まれたチャネルを透過するイオンの流れを測定します
次に、チャネル蛋白の1分子同時計測の例を示します。私達は、チャネル蛋白をアガロース上に形成した脂質二重膜に組み込むために、いわゆるベシクル 融合法を用いています。ウシの気管平滑筋から調製した細胞膜ベシクルに存在するBKチャネルを、特異的モノクローナル抗体を介して蛍光標識し、ベシクル融
合法で人工膜に再構成した時の結果が下の図です。
私達の当面の目標は、チャネル蛋白と薬物との相互作用計測ですので、チャネル蛋白の人工膜上での位置のみが検出されれば十分です。そこで、検出 を容易にするために、抗体分子を多数の蛍光分子で標識しています。図に示す例では、抗体分子1分子当たり、6-7個の蛍光分子が結合しており、また、BK
チャネルがホモ四量体であることを考えると、チャネル1分子当たり約25個の蛍光色素で標識されていると考えられます。勿論、蛍光分子1分子で標識された
チャネルに関しても、全く同じ方法で観察することが可能です。チャネル蛋白の内部構造変化を検出する場合などには、組み換え体を用いるなどして、蛋白に直
接蛍光標識をする必要がありますが、この場合にも全く同様にして、ベシクル融合法を用いて標識チャネル蛋白を平面膜に再構成することが可能です。
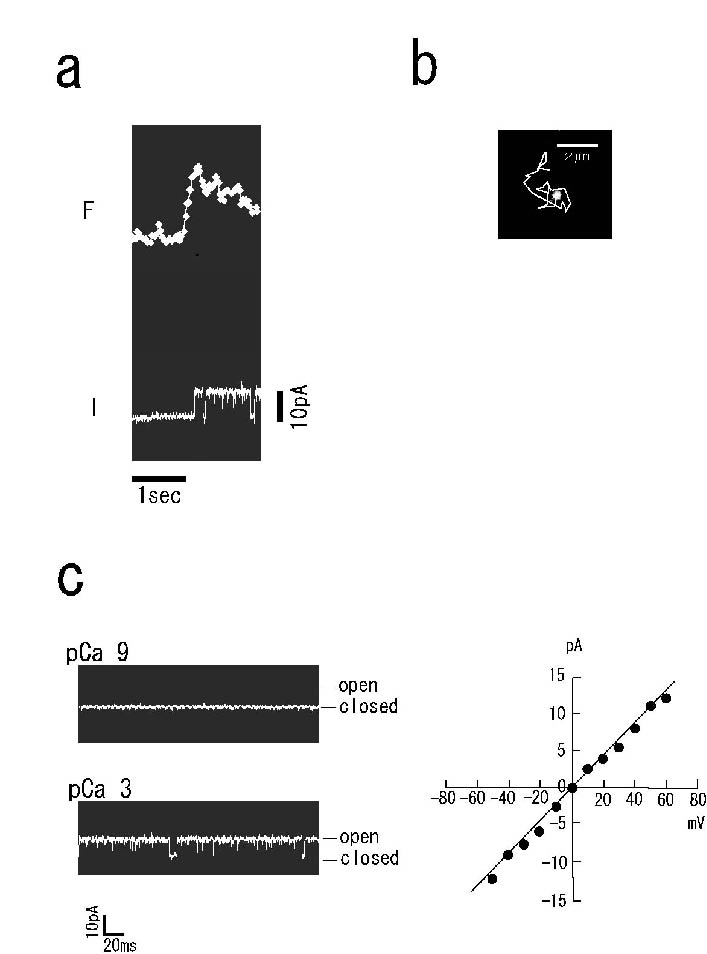
BKチャネルが人工膜に組み込まれる瞬間を電気・光学的とらえた実験結果が図aです。平面膜を介した電流が大きく揺らぎ始めるのと同時に、(ビ デオフレームで2-3フレーム先行して)強い蛍光信号が現れているのが分かります。実験溶液中にはmM程度のCa2+が添加されているので、チャネルは融
合前にベシクル膜上に存在するときから、開状態にあると考えられ、融合の瞬間には既にゲートが開いていると予想されます。よって、図は、Cy5で標識され
たチャネルを含むベシクルが膜に接近し、エバネッセント場によって色素が励起され、そのベシクルが融合することにより開状態にあったチャネルが人工膜に組
み込まれた様子を示していると考えてよいと思われます。蛍光信号が、時間とともに徐々に減少しているのは、蛍光の褪色過程を表しています。このような方法
で再構成されたBKチャネル分子は、図bにあるように脂質平面膜内を2次元熱運動していることが分かります。また、図cに示すように、この方法を用いて得
られたチャネルの電気的特性は、パッチクランプ法や従来型の平面膜法を用いて得られた結果と全く同様で、これを用いて正常な単一チャネル電流記録を行える
と判断してよいとおもわれます。
(参考)
- T. Ide, Y. Takeuchi, T. Aoki, and T. Yanagida (2002)
Simultaneous optical and electrical recording of a single ion-channel. Jpn J Physiol. 52 (5): 429-434 (abstract/PDF)
→研究内容
|

