Top > 研究プロジェクト > 細胞内自己組織化による自発的極性形成
細胞内自己組織化による自発的極性形成
イノシトールリン脂質代謝システム(PTEN-PI3K系)
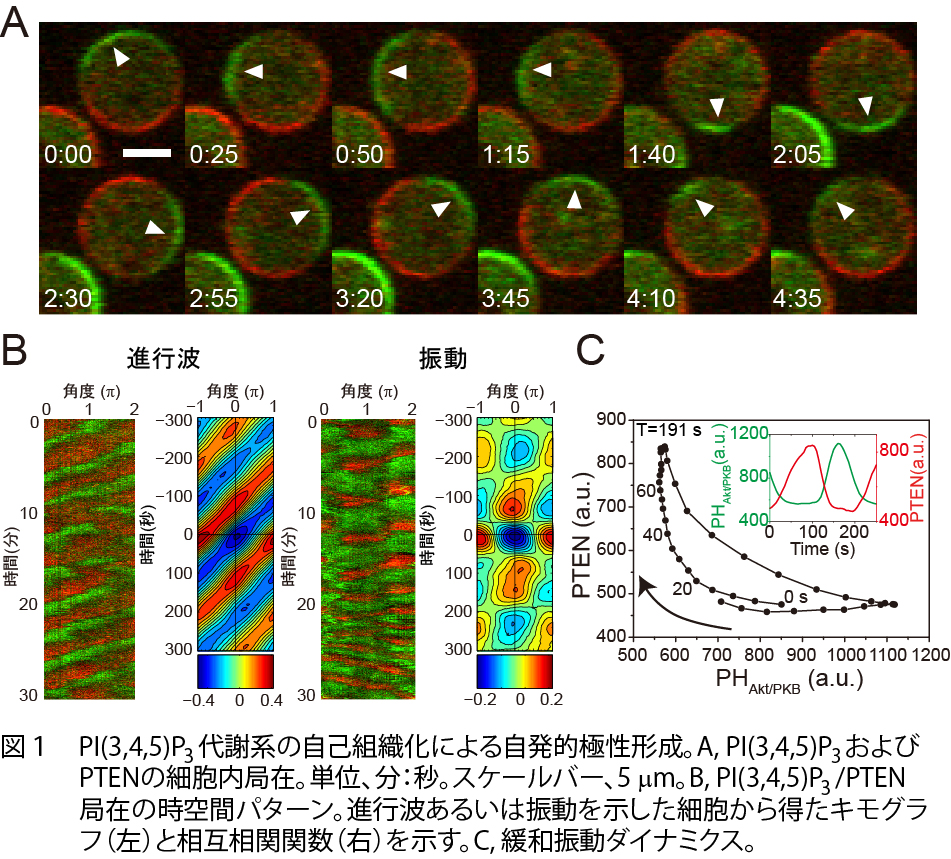
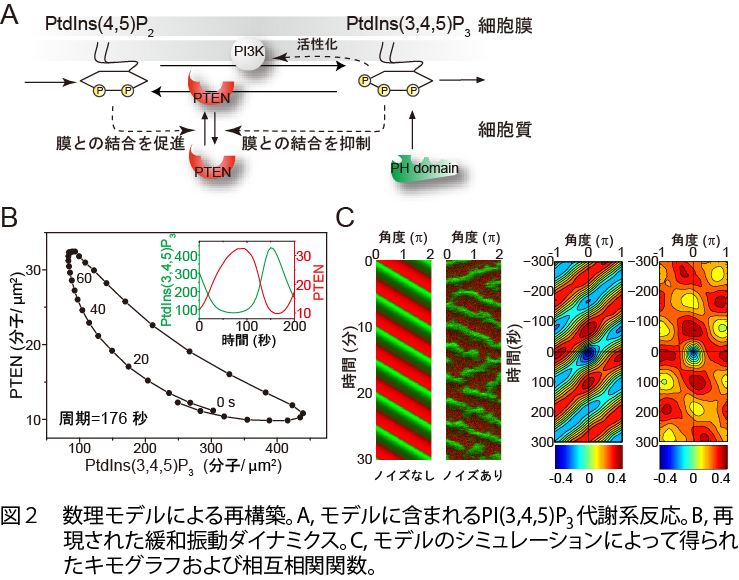
細胞は一定な環境においてもランダムに方向転換を繰り返しながら自発的に移動運動を行います(動画)。 したがって、細胞の前後極性を制御するシグナルは、細胞外部環境によらず細胞内部システムにおいて自発的に 生成されていると考えられます。前後極性を決定するシグナル分子として、白血球や粘菌細胞を用いた研究から、 細胞膜に存在するイノシトールリン脂質であるPI(3,4,5)P3が見つかっており、細胞の前側と後ろ側 でそれぞれPI3-kinaseとPTENがPI(3,4,5)P3の合成と分解反応を触媒する結果、前側でPI(3,4,5)P3 が蓄積することが知られています1)(動画1)。私たちは、PI(3,4,5)P3代謝系の自己組織化が、 極性制御における自発的シグナル生成機構として働いていることを明らかにしました2)。空間的に均一な環境に 移動運動を阻害された状態でおかれた細胞においても、PI(3,4,5)P3とPTENは相互排他的に細胞膜に 局在することから、これらのシグナル分子の膜上での極性が自己組織化的に形成されていることが示唆されます。 両者の局在パターンは、細胞膜上を伝搬するように移動したり(traveling wave, 進行波)、ある時間毎に局在が 入れ換わったり(spatiotemporal oscillation, 振動)しており、振動的な局在の時間変化 (PI(3,4,5)P3/PTEN wave)はPI3-kinaseとPTENの活性に依存していました(動画2、図1AB)。 これらの酵素活性は自発運動を効率よく行うために必須であり、PI(3,4,5)P3/PTEN waveがそのシグナル として関与していることが示唆されます。PI(3,4,5)P3/PTEN wave の時空間パターンは細胞ごとで異なる 多様性を示しましたが、どの細胞においても共通の緩和振動(relaxation oscillation)ダイナミクスで説明できます (図1C)。これらの観察・解析結果はPI3-kinaseとPTENによる代謝反応を含めた反応拡散方程式に基づいた数理モデル によって再現することができ、確率的なシミュレーションなどから、分子反応ゆらぎが時空間パターンの多様化に生かさ れていることが示唆されました(図2)。したがって、細胞極性の制御システムは、自発的な性質として、ランダムさを 伴うシグナルを分子反応ネットワークに内在する確率的なゆらぎを織り込んでロバストに生成できると考えられます。 分子の確率性に起因して細胞極性の時空間ダイナミクスが多様化することにより、細胞のランダムな自発運動が可能と なっていると考えられます。こうした細胞システムとしてのゆらぎは、外部環境の変動に対して適応する場合に有利に 働く可能性があり、ゆらぎを免れ得ない生体システムに固有の設計・動作原理の解明に役立つことが期待されます。
| 動画1:avi | 動画2:avi |
動画1 自発運動時のPI(3,4,5)P3代謝系構成分子の細胞内局在。緑:PHD-GFP、赤:PTEN-TMR。PHD(Akt/PKBのPHドメイン)はPI(3,4,5)P3との結合活性を持つ。
動画2 PI(3,4,5)P3代謝系の自己組織化による自発的極性形成。5 μM Latrunculin A添加により細胞骨格を破壊している。
参考文献
1) Swaney, K. F. et al.: Annu. Rev. Biophys., 39:265-289, 2010.
2) Arai, Y. et al.: PNAS, 107:12399-12404, 2010.
