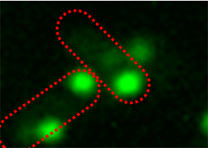
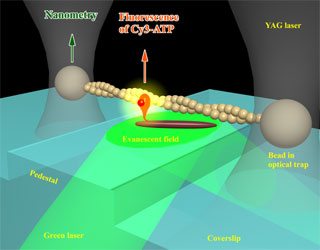
バクテリアべん毛モーターは,こちら,でも書きましたように,生物界において珍しい回転機構を有する運動機関です.
入力エネルギーはイオンの流れであり,種により,水素,ナトリウムなどのイオンが通過して,トルクを発生します.
イオンを通過し,トルクを発生するステーター,回転するローターからなり,一つのモーターにステーターは11個程度あることが知られています.
分子モーターの動作原理を解明するためには,その素過程を明らかにすることが第一に行うことであり,ミオシンVの35nm,キネシン,ダイニンの8nmステップなどの素過程が明らかにされています.
しかし,べん毛モーターにおいては,
トルク発生ユニットであるステーターが複数存在する(11個程度)
一つあたりのステップが小さい可能性がある
(1回転÷1,000イオン/1回転=0.36度)
回転数が早い(大腸菌で200Hz程度=1回転あたり5ms)
入力の調整ができない
(大腸菌の場合,外部イオン濃度を変えても,
大腸菌自体が内部イオン濃度などを調整してしまう)
という困難さがあり,今まで誰も明らかにすることができませんでした.
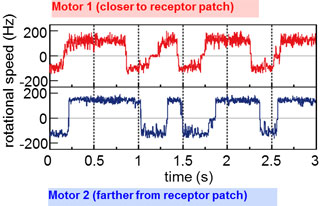
我々は,キメラモーターを用いて上記の問題点を克服し,初めてバクテリアべん毛モーターの回転素過程を明らかにすることができました (Sowa, et., al., 2005, Nature).
その結果,
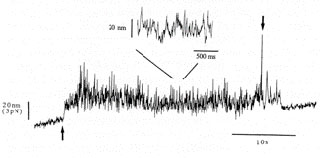
1回転あたり26ステップ(約14度)
であることを見いだし,この26という値はローターの構成蛋白の一つである,FliG,の数と一致することを見いだしました.
従来から,FliG,はステーターと相互作用してトルクを発生する,と言われていましたが,我われの結果はそれを裏付けるものです.
現在,さらなる分解能の向上を目指し,素過程の詳細,について研究を続けているところです.
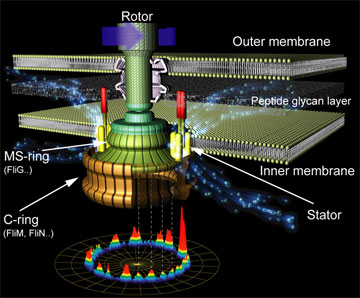
バクテリアべん毛モーター
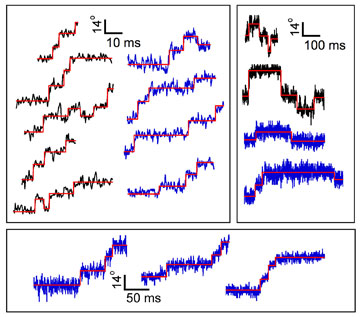
ステップの拡大図(縦軸角度,横軸時間)