べん毛モーターがバイオセンサーとして働くしくみを解明
| 原著論文 | Sci Adv 3 (2017) |
|---|---|
| 論文タイトル | Na+-induced structural transition of MotPS for stator assembly of the Bacillus flagellar motor |
| 研究室サイト | 日本電子YOKOGUSHI協働研究所〈難波 啓一 特任教授(常勤)〉 |
概要
大阪大学大学院生命機能研究科の寺原直矢特任助教(常勤)、南野徹准教授、難波啓一特任教授(常勤)、金沢大学理工研究域バイオAFM先端研究センターの古寺哲幸准教授、安藤敏夫特任教授、名古屋大学大学院理学研究科の内橋貴之教授の共同研究グループは、細菌べん毛モーターのエネルギー変換装置である固定子複合体がナトリウムイオンを感知して活性化し、モーターに組み込まれるしくみを世界で初めて明らかにしました。
バクテリアはべん毛と呼ばれる回転分子モーターを使って最適な環境へ移動します。べん毛モーターは回転運動マシナリーとして働くだけではなく、環境変化を感知するバイオセンサーとしても機能します。そのため、べん毛モーターが環境変化を感知するとバクテリアの細胞分化が誘導されたり、バイオフィルムと呼ばれる細菌社会が形成されます。これまでに、べん毛モーターが回転するしくみについては詳細に解析されていますが、バイオセンサーとして働くしくみについては長い間謎でした。最近、べん毛モーターの固定子複合体が外環境変化を感知し、回転子リング複合体の周りに配置される固定子の数を自律的に制御することがわかってきました。しかしながら、膜タンパク質である固定子複合体はその取り扱いが大変困難であったため、詳細なしくみは不明でした。
今回、共同研究グループは、固定子複合体を単離精製することに成功し、高時間高空間分解能で生体分子の観察が可能な高速原子間力顕微鏡を用いて、世界で初めて固定子複合体1分子の振る舞いをリアルタイムで可視化することに成功しました。モーターを回転させるために必要なエネルギー源であるナトリウムイオンが結合すると固定子の一部が規則正しく折りたたまれ、その結果モーターに組み込まれることを明らかにしました。本研究成果は、高効率で回転するモーターの回転機構の解明への第一歩とともに、生体内のナトリウムイオン正確に測定できるバイオセンサープローブへの応用や、ナトリウムイオンによって生体分子の機能をON/OFF制御できるナノデバイスへの応用が期待されます。
研究の背景
大腸菌やサルモネラ属菌などの多くの細菌は、べん毛と呼ばれる細い長いらせん状の繊維を菌体から生やし、回転させることによって様々な環境を移動します(図1)。その根元には、人工のモーターに非常によく似た回転分子モーターが細胞膜の中に存在します。べん毛モーターは回転子と固定子から構成され、これらの相互作用によってモーターが回転します。モーターのエネルギー源は細胞の外から内に流れるイオン流で、固定子はこのエネルギーを回転力に変換します。その変換効率はほぼ100%で、大変高性能なナノマシンです。さらに、べん毛は環境変化を感知するバイオセンサーとしても働き、水の中を泳ぐモードから固体表面を移動するモードへと細胞を分化誘導したり、バイオフィルムと呼ばれる細菌社会の構築を誘導したりします。
本研究の成果
本共同研究グループは、固定子の中でもバチルス属細菌が持つ、ナトリウムイオンで動くMotPS複合体に着目しました。MotPS複合体はナトリウムイオンを感知して固定子として働くことができます。これまで単離精製が困難だったMotPS複合体の精製に成功し、高速原子間力顕微鏡によりこの複合体の動態計測を行いました。その結果、MotPS複合体は大きな楕円状のドメインと小さな楕円状のドメインがリンカーで繋がった分子形態をとっていること(図1)、大きいドメインが細胞膜ドメインで、小さいドメインがペプチドグリカン結合ドメインであること、ナトリウムイオンが存在しない時はペプチドグリカン結合ドメインの立体構造が解きほぐされてひも状になり、ナトリウムイオンを添加すると再び折りたたまれてきちんとした立体構造をとること(図2)、リンカー領域が最大で5nm伸びたり縮んだりすることなどを明らかにしました。以上の結果から、ナトリウムイオンがペプチドグリカン結合ドメインに結合するとこのドメインは折りたたまれて立体構造をとり、その結果MotPS複合体がモーターに組み込まれてナトリウムイオン駆動型の固定子として働くことが示唆されました。(図3)。
研究成果のポイント
- 細菌べん毛モーターを回す固定子複合体の動的構造変化を高速原子間力顕微鏡で解析することにより、固定子複合体が外環境のナトリウムイオンを感知してモーターに組み込まれるしくみを解明
- 精製が困難であったため、固定子複合体がナトリウムイオンを感知できるしくみは不明であったが、固定子の一部がナトリウムイオンによって機能構造を形成することを発見
- 生体内のナトリウムイオン濃度を正確に計測できるセンサープローブの開発などに期待
本研究成果が社会に与える影響(本研究成果の意義)
細菌べん毛モーターはおよそ30種類のタンパク質から作られる超分子複合体のナノマシンで、機械工学や医療の分野で大変注目を集めています。私たち人類の科学力ではまだ人工的に作れませんが、細菌という単純な生物がはるか昔からこのような高性能マシンを作り利用していることに驚かされます。
本研究では高速原子間力顕微鏡観察によって、モーターの心臓部である固定子複合体1分子の振る舞いをリアルタイムで捉えることに世界で初めて成功しました。固定子はモーターを回転させるために必要なエネルギー源があるときのみ活性化しモーターに組み込まれるというように、「今使えるエネルギー」を選択していることを明らかにしました。今後、このような外環境変化を感知して効率的にエネルギーを変換するしくみを利用して、生体内のナトリウムイオン濃度を定量的に計測できるバイオセンサープローブの開発や、ナトリウムイオンで生体分子の機能をON/OFFできるデバイスの開発など、機械工学や医療分野への応用が期待されます。さらに本研究成果は、高効率で環境に優しいイオンエネルギーを利用するべん毛モーターの回転機構の解明への大きな第一歩となりました。べん毛モーターから学ぶ人工ナノマシンの設計にも大いに役立つと考えられます。
特記事項
本研究成果は、2017年11月2日(木)午前4時(日本時間)に米国科学誌「Science Advances」(オンライン)に掲載されました。
なお、本研究は、科学研究費補助金、科学技術振興機構戦略的研究推進事業CRESTおよびさきがけ研究の一環として行われ、金沢大学大学院理工研究域 安藤敏夫教授と古寺哲幸准教授、さらには名古屋大学大学院理学研究科 内橋貴之教授の協力を得て行われました。
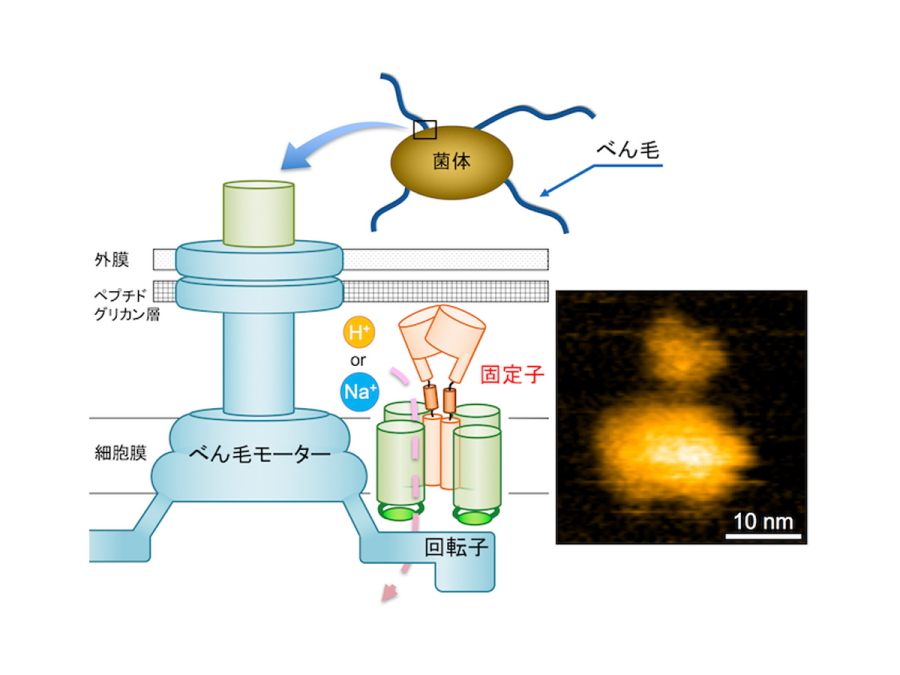
図1.べん毛モーターの模式図と固定子複合体の高速原子間力顕微鏡像
これまでに、べん毛モーターの固定子がバイオセンサーとして働くことが示唆されています。固定子は大まかに分けて、イオンチャネルとして働く細胞膜ドメインと、細菌の細胞壁に相当するペプチドグリカン層に結合するペプチドグリカン結合ドメインから構成されます。固定子が外環境の変化を感知する際、ペプチドグリカン結合ドメインがその情報を得て、べん毛モーターの周りに配置される固定子の数が制御されます。しかし、そのしくみは全く謎でした。固定子を複合体の状態のまま精製するという大変困難な課題があったからです。

図2.塩化ナトリウム(NaCl)の濃度変化による固定子複合体の構造変化
NaClの濃度を徐々に増やすとペプチドグリカン結合ドメインがひも状からたま状へと変化(上段)。逆に減らすと再びひも状に戻る(下段)。どちらの場合も、およそ130mMあたりで構造が切り替わる。
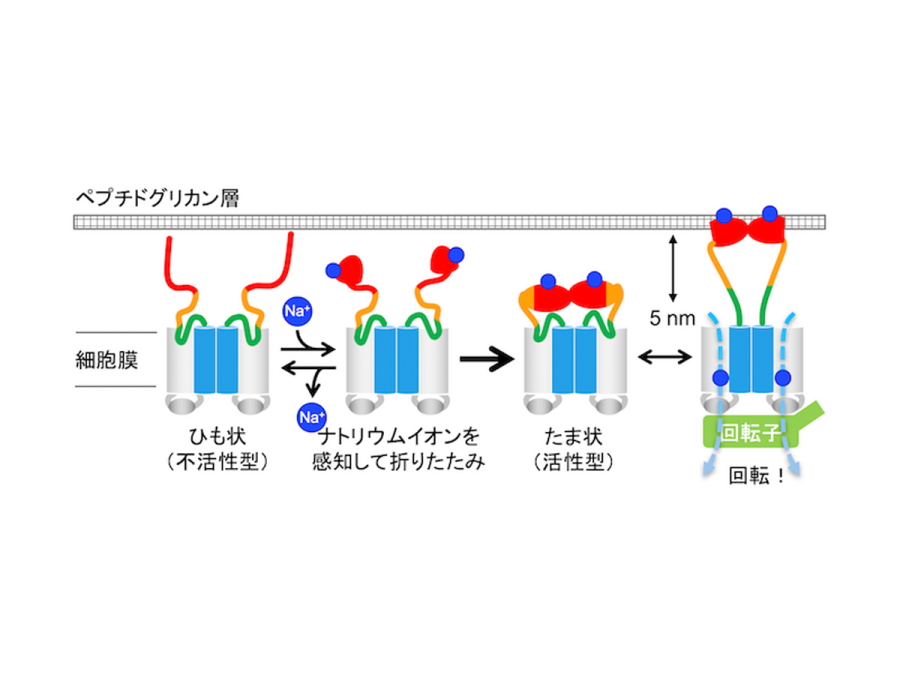
図3.固定子複合体の組み込まれる過程
ペプチドグリカン結合ドメインがナトリウムイオンを感知し、ひも状からたま状へと折りたたまれて活性化する。活性型の複合体はモーターに組み込まれると、ペプチドグリカン結合ドメインがおよそ5 nm伸びてペプチドグリカン層に結合し、モーターを回転させる。
用語解説
- 固定子複合体
細胞外から細胞内に特定のイオンを流す膜タンパク質複合体。固定子はこのイオンの流れを回転力に変換する。1つのモーターに対して最大およそ10個の複合体が組み込まれる。“固定”子と呼ばれるが、組み込まれた固定子がモーターから外れたり再度組み込まれたりと、常にダイナミックに入れ替わっていることが最近明らかになってきた。 - 膜タンパク質
細胞膜などのリン脂質2重層で形成される膜内に存在するタンパク質。細胞膜を隔てて各種イオンを流すイオンチャネルや栄養源などの物質を運ぶトランスポーターなどが知られている。 - 高速原子間力顕微鏡
カンチレバーと呼ばれる鋭い探針で試料表面をなぞることで試料表面の凹凸を可視化する顕微鏡。金沢大学の安藤敏夫教授の研究グループによって高速化および生体試料の観察が実現し、溶液中で生体分子の反応や構造変化を高分解能かつリアルタイムでの観察が可能となった。 - バチルス属細菌
水中や土壌などいたるところに存在する細菌。モデル生物として知られている枯草菌をはじめ、酵素などの有用物質を生産する種も多く、古くから様々な産業に用いられている。納豆菌が特に有名。
| 原著論文 | Sci Adv 3 (2017) |
|---|---|
| 論文タイトル | Na+-induced structural transition of MotPS for stator assembly of the Bacillus flagellar motor |
| 著者 | Naoya Terahara (1), Noriyuki Kodera (2), Takayuki Uchihashi (2, 3, 4), Toshio Ando (2, 5), Keiichi Namba (1, 6) ,Tohru Minamino (1)
|
| PubMed | 29109979 |
