世界初!
細菌べん毛III型輸送装置ができるしくみを解明
| 原著論文 | PLoS Biol (2017) |
|---|---|
| 論文タイトル | Assembly and stoichiometry of the core structure of the bacterial flagellar type III export gate complex |
| 研究室サイト | 日本電子YOKOGUSHI協働研究所〈難波 啓一 特任教授(常勤)〉 |
概要
大阪大学大学院生命機能研究科の南野徹准教授、難波啓一特任教授(常勤)らの研究グループと同大学院理学研究科の今田勝巳教授の研究グループは、細菌べん毛を作るために必要なタンパク質輸送装置がべん毛の根元にできるしくみを世界で初めて明らかにしました。
細菌の細胞表層にはべん毛と呼ばれるタンパク質でできた細長い繊維状の運動器官が生えていて、細菌はこれを使って水中を活発に泳ぎます。べん毛は細胞の外にできるので、べん毛繊維の根元には独自のタンパク質輸送装置が存在します(図1)。そのタンパク質輸送装置が、細胞内で合成されたべん毛タンパク質を認識し、べん毛中心を貫通する直径1.3nmの細長い穴の中を通して先端へ輸送します。べん毛タンパク質輸送装置は6種類の膜タンパク質でできた輸送ゲート複合体と3種類の可溶性タンパク質でできたATP分解酵素複合体で構成されます(図2)。これまでに、ATP分解酵素複合体の構造や機能は詳細に解析されていますが、輸送ゲート複合体は取り扱いが困難であるため、ほとんど解析されていません。したがって、6種類のべん毛基部で膜タンパク質から輸送ゲート複合体ができあがるしくみは長い間謎でした。
今回、共同研究グループは、輸送ゲート構成タンパク質を単離精製することに成功し、世界で初めてその構造や輸送ゲート複合体ができるしくみを明らかにしました。これにより、べん毛タンパク質輸送装置と機能的にも構造的にも同じしくみを持つ、病原細菌のIII型分泌装置の膜タンパク質複合体を直接ターゲットにした創薬スクリーニングが可能になり、腸内細菌叢を死滅させることなく、病原細菌との共生もが可能となる、全く新しいタイプの感染症薬の開発が可能になると期待されます。
研究の背景
細菌の細胞表層にべん毛を作るタンパク質輸送装置は、6種類の膜タンパク質(FlhA, FlhB, FliO, FliP, FliQ, FliR)からなる輸送ゲート複合体と3種類の可溶性タンパク質(FliH, FliI, FliJ)からなるATP分解酵素複合体で構成されることが知られています(図2)。しかし、細胞膜からべん毛を単離精製すると、精製に用いる界面活性剤で輸送ゲートタンパク質の大半が脱落するため、輸送ゲートタンパク質の位置や6種類の膜タンパク質から輸送ゲートができるしくみは不明でした。
本研究の成果
本共同研究グループは、これまで単離精製が困難だった輸送ゲートタンパク質FliOおよびFliPの大量精製に成功し、大型放射光施設SPring-8を用いたX線結晶構造解析法や電子顕微鏡による構造解析法により立体構造を詳細に解析しました。その結果、2分子のFliPでできたユニットが3つ集まって直径10nmのリング構造を形成すること(図3)、FliO複合体がFliPに直接結合してFliPのリング形成を助けること、FliO複合体はできあがった輸送ゲートには存在しないことが判明しました。さらに、残りの4種類の輸送ゲートタンパク質(FliQ,FliR,FlhB,FlhA)がFliPリングに直接結合すること、FlhAがべん毛基部のMSリングに直接結合することも明らかになりました。
以上の結果から、輸送ゲートがMSリング部に形成されるしくみは次のようになります。まず、FliO複合体の働きでFliPリングが形成され、次にFliO複合体がはずれてFliQ、FliR、FlhBがFliPリングの周りに集合します。そして最後にMSリングの形成と並行しながら、FlhAがFliP/FliQ/FliR/FlhB複合体を取り囲むように集合することで、MSリング内部に輸送ゲートが組み上がります(図4)。
本研究は長い間謎であった輸送ゲートの部分構造を原子レベルで解明するとともに、輸送ゲートができあがるしくみを明らかにしました。今後、本研究成果をもとに、未解明の輸送ゲートがべん毛タンパク質を輸送するしくみの研究発展が期待されます。
研究成果のポイント
- べん毛タンパク質輸送装置を構成する膜タンパク質複合体の立体構造を原子レベルで解析することにより、膜貫通型輸送ゲートができる順序やしくみを解明
- これまで、輸送ゲート複合体は取り扱いが難しく、輸送ゲートタンパク質の位置や輸送ゲートができるしくみは不明だった
- 病原細菌のIII型分泌装置の輸送ゲートをターゲットにした創薬スクリーニングへの応用による全く新しいタイプの感染症薬の開発に期待
本研究成果が社会に与える影響(本研究成果の意義)
抗菌剤は細菌感染症対策の主流ですが、多剤耐性菌の出現により治療困難な感染症が増え、新たな着眼点からの感染症対策が急務となっています。病原細菌が感染する際に用いるIII型分泌装置は細菌特有のもので、しかも病原細菌の生存に必須ではありません。もしIII型分泌装置の働きだけを不活化できる薬剤が見つかれば病原細菌の病原性のみを破壊することが可能となります。III型分泌装置は機能的にも構造的にもべん毛タンパク質輸送装置と似ていますので、本研究成果によりIII型分泌装置の輸送ゲートを直接ターゲットにした創薬スクリーニングが可能となり、社会的な重要課題である新興細菌感染症を制御するための新技術開発に貢献すると期待されます。
特記事項
本研究成果は、2017年8月4日(金)午前3時(日本時間)に米国科学誌「PLOS Biology」(オンライン)に掲載されました。
なお、本研究は、科学研究費補助金の支援のもとに行われました。
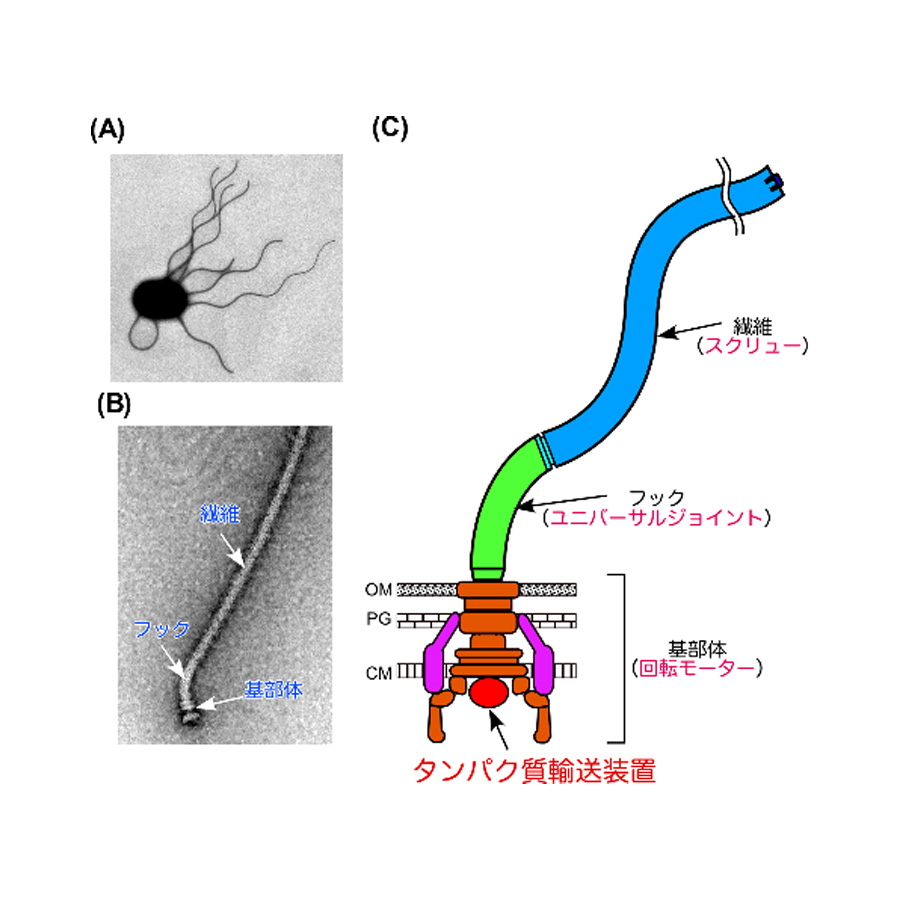
図1.細菌べん毛の構造
(A)サルモネラ属菌の電子顕微鏡写真.(B)サルモネラ属菌から単離精製された電子顕微鏡写真.(C)べん毛の模式図.OMは外膜、PGはペプチドグリカン層、CMは細胞膜を示す。
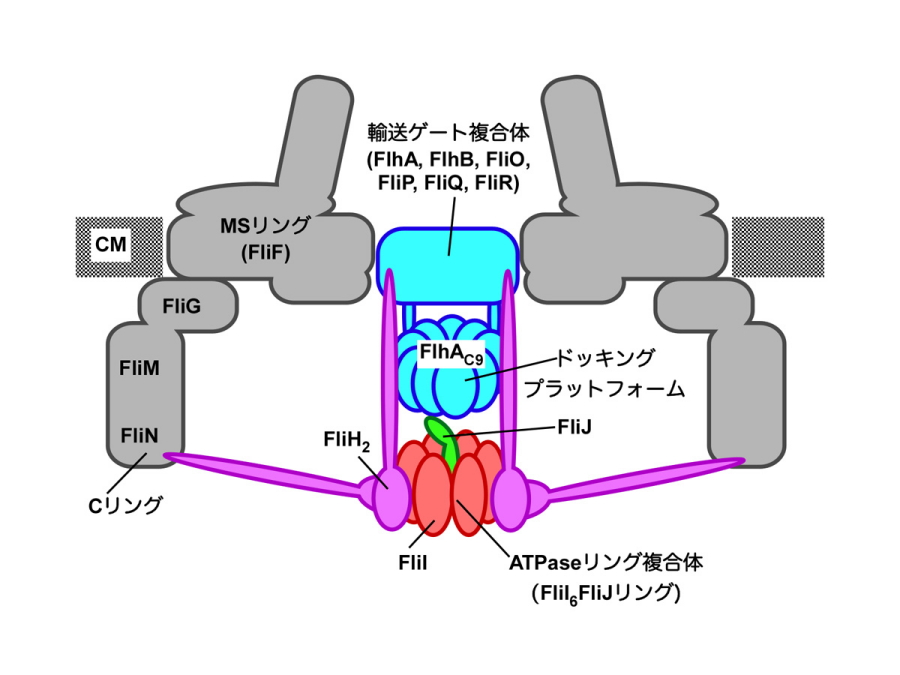
図2.細菌べん毛タンパク質輸送装置の模式図
輸送装置はべん毛基部に存在するMS-Cリング複合体の内部に存在する。輸送装置は6種類の膜タンパク質FlhA,FlhB,FliO,FliP,FliQ,FliRからなる輸送ゲート複合体と3種類の可溶性タンパク質FliH,FliI,FliJからなるATP加水分解酵素複合体から構成される。CMは細胞膜を示す。
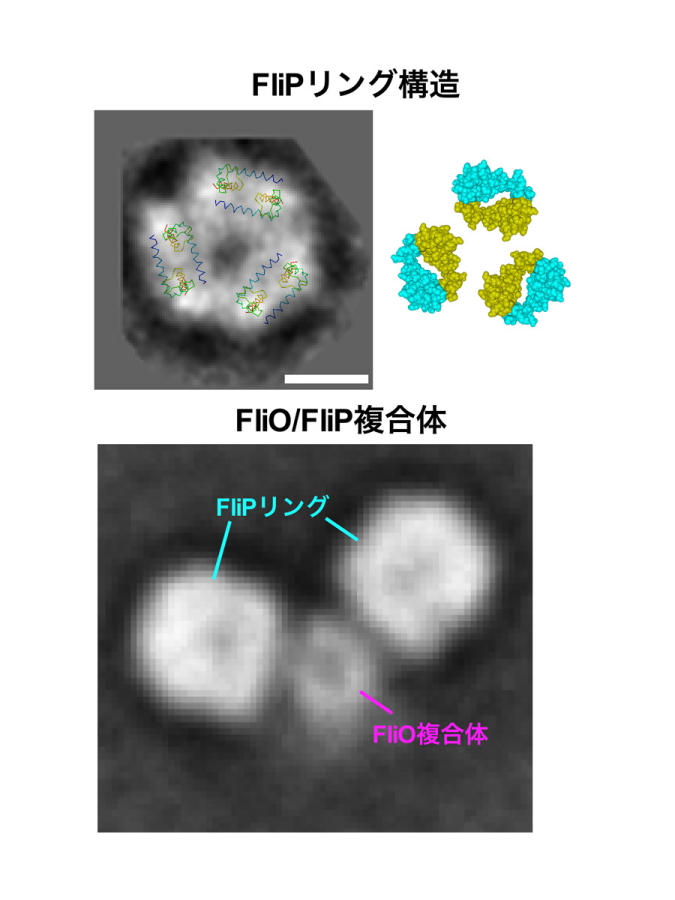
図3.FliPリング構造モデル
右上側はX線結晶構造解析で解かれたFliPの部分構造。結晶中で2量体が形成されていた。左上側にある図は、この2量体構造を、FliPリング複合体の電子顕微鏡像の2次元平均像に当てはめたもの。スケールバーは5nm。FliO/FliP複合体の電子顕微鏡写真。下側は2分子のFliPリングがFliO複合体に結合している様子。
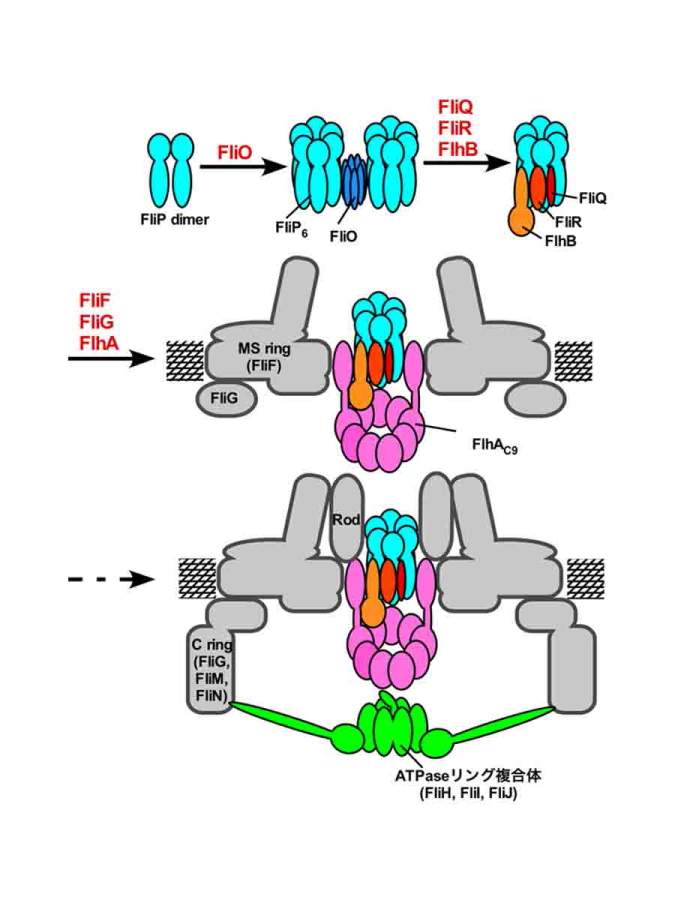
図4.輸送ゲート複合体の形成メカニズム
用語解説
- タンパク質輸送装置
生体膜を透過させてタンパク質を細胞外へ送り出す装置。 - 膜タンパク質
細胞膜などの脂質2重層で構成される厚さ6nm程度の膜を貫通して存在するタンパク質の一般名称。 - ATP分解酵素
生体エネルギーの一つであるアデノシン三リン酸(ATP)を加水分解する酵素の一般名称で、生体内の様々な化学・力学反応機構のエネルギー供給源として働く。 - 界面活性剤
分子内に水になじみやすい部分と油になじみやすい部分を持つ物質の総称で、膜タンパク質を脂質2重膜から抽出することができる。
| 原著論文 | PLoS Biol (2017) |
|---|---|
| 論文タイトル | Assembly and stoichiometry of the core structure of the bacterial flagellar type III export gate complex |
| 著者 | Takuma Fukumura (1), Fumiaki Makino (1), Tobias Dietsche (2), Miki Kinoshita (1), Takayuki Kato (1), Samuel Wagner (2, 3), Keiichi Namba (1, 4), Katsumi Imada (5), Tohru Minamino (1)
|
| PubMed | 28771466 |
