生成中のRNAは核小体の内部構造を制御する「界面活性剤」として働く
分子生物学とソフトマター物理学の融合研究で核小体の海島型多相構造の謎に迫る
| 原著論文 | Commun. Biol. 6(1):1129 (2023) |
|---|---|
| 論文タイトル | Nascent ribosomal RNA act as surfactant that suppresses growth of fibrillar centers in nucleolus |
| 研究室サイト | RNA生体機能研究室〈廣瀬 哲郎 教授〉 |
概要
北海道大学創成研究機構化学反応創成研究拠点(WPI-ICReDD)の山本哲也特任准教授、大阪大学大学院生命機能研究科の山崎智弘特任講師(常勤)、二宮賢介特任講師(常勤)、廣瀬哲郎教授らの研究グループは、核小体のサブコンパートメントである繊維状中心の大きさは、転写の間に生成される新生リボソームRNAが発生する表面(浸透)圧によって制御されることを、ソフトマター物理学(理論)と分子生物学(実験)の融合研究によって明らかにしました。
核小体は、タンパク質の合成に必要なRNA-タンパク質複合体であるリボソームを生成する核内構造体です。核小体は一様な液滴ではなく、複数のサブコンパートメントが分散した海島型の多相構造を形成します。これまでの研究では、核小体の多相構造も「液液相分離」によって形成されていると考えられてきました。液液相分離とは、サラダドレッシングを放っておくと、水を主成分とする液体領域と油を主成分とする液体領域に分離してしまうのと同じ現象です。液液相分離で形成された液滴は、時間が経つと融合してしまうという性質がありますが、このことは複数のサブコンパートメントが分散しているということと矛盾します。リボソームの骨格となるRNAであるリボソームRNAを生成するプロセスである「転写」を抑制すると、(液液相分離によって形成された液滴のように)サブコンパートメントが融合することから、転写が海島構造を安定化する原因であると考えられます。
リボソームRNAの転写は、サブコンパートメントの表面で起きることが知られています。本研究では、生成途中のリボソームRNAがサブコンパートメントの表面に局在化されていることに注目し、サブコンパートメントの大きさを解析するための理論モデルを構築しました。この理論を解析することによって、毎分生成されるリボソームRNAの数を大きくすると、安定なサブコンパートメントの半径が大きくなり、数も増加しました。さらに、生成されるリボソームRNAの生成数を薬剤添加によって変化させたところ、構築した理論と定量的に一致する結果を得ました。
研究の背景
DNAの塩基配列として蓄えられている遺伝情報は、対応するタンパク質を合成することによってその機能を果たします。リボソームは、タンパク質の合成を担うRNAとタンパク質の複合体で、核内にある核小体という構造の中で生成されます。ヒトなどの高等生物では、核小体はタンパク質とRNAの一様な凝集体ではなく、顆粒部(granular component、以下、GC)の中に、複数の繊維状中心部(fibrillar center、以下、FC)が分散した海島型の多相構造(海の中に複数の島があるような構造)を形成しています(図1)。GCとFCの間には、高密度繊維状部(dense fibrillar component、以下、DFC)という層状の構造も形成されています。リボソームの骨格となるリボソームRNAは、FCの表面で形成されていますので、FCの大きさや表面積は、リボソームRNAの生成効率に影響する重要な量であると考えられます。
サラダドレッシングを放っておくと、水を主成分とする部分と油を主成分とする部分に分離してしまいます。このような現象は液液相分離とよばれます。GCの主な成分であるヌクレオフォスミンやDFCの主成分であるフィブリラリンなどのタンパク質は、(油と同じように)水と混ぜ合わせようとしても分離してしまうので、核小体の多相構造は液液相分離によって形成されていると考えられてきました。水と油の系で、ある時点で水の中に多数の油の液滴があっても、時間が経つにつれてそれらが融合してしまうように、液液相分離で形成された液滴は融合するという性質があります。この性質は、核小体内で多数のFCが分散しているという事実と矛盾します。興味深いことに、リボソームRNAを生成するプロセスである「転写」を抑制すると、液液相分離で形成された液滴と同様、FCが融合して大きな液滴になってしまいます。リボソームRNAの転写は、どのようなメカニズムでFCの融合を阻止し、核小体の多相構造を制御しているのでしょうか?
核小体を含むいくつかの核内構造体は、arcRNAと呼ばれる特定のRNA群を足場にして形成されることが、RNA分子生物学のグループである廣瀬グループによって明らかにされてきました。一方、物質科学の観点からは、リボソームRNAは高分子と呼ばれる物質群の一つであり、高分子の性質や多数の高分子が集まって様々な構造を形成する現象(自己組織化)は、ソフトマター物理学で研究されてきました。本研究では、ソフトマター物理学者である山本特任准教授とRNA分子生物学者である山崎特任講師(常勤)、二宮特任講師(常勤)、廣瀬教授がタッグを組み、リボソームRNAの転写が核小体の多相構造を制御する謎に挑みました。
本研究の成果
ある時点で水の中に複数の油の液滴があったとしても、時間が経つにつれて融合してしまう原因は、油の液滴の表面に働く表面張力です。洗剤などの界面活性剤を加えると、界面活性剤は水と油の界面に集まって表面張力を緩和します。界面活性剤の種類と濃度によっては、水と油の表面張力をほぼゼロにして、水の中に多数の油の液滴を分散させることができます(マイクロエマルション )。核小体内で、リボソームRNAの鋳型となるDNA配列はFC領域にあり、リボソームRNAの転写はFCの表面で起きます。そのため、生成途中のリボソームRNA(新生リボソームRNA)はFCの表面に局在化しています。
研究グループは、このFCの表面にある新生リボソームRNAが、界面活性剤と同様に、表面張力を緩和する力である表面(浸透)圧を発生し、多数のFCをGCの中に分散させるのではないかという着想に至りました。FCの表面に局在化している新生リボソームRNAに注目し、転写によって毎分生成されるリボソームRNAの数を変えたときに、FCの大きさと数がどのように変わるかということを予測することのできる理論モデルを構築しました。また、加える濃度に応じて連続的にリボソームRNAの生成量を少なくできる薬剤を用いて、リボソームの生成量を変えてFCの大きさの関係を測定し、この理論の検証を行いました。
FCとGCの間にあるDFCの主成分であるフィブリラリンは、リボソームRNAの末端部位に結合するタンパク質です。研究グループの構築した理論を解析することによって、フィブリラリンは凝集する性質があるために、新生リボソームRNAの末端領域に結合したフィブリラリンが、多くのフィブリラリンをDFC層に呼び込むことによって、DFCに分布している新生リボソームRNAの末端領域が伸びた状態になっているという結果を得ました。このことは、新生リボソームRNAの末端領域がDFCに局在化しており、フィブリラリンがその局在に重要な役割を果たすという最近の実験結果と、FCの半径とDFCの厚さが同じくらいであるというこれまで広く知られていた事実をよく説明します。
また、構築した理論を解析することによって、毎分生成されるリボソームRNAの数を小さくすると、その-1/2乗に比例してFCの半径が大きくなるという結果を得ました。理論で予言される量は、多くの場合、様々なパラメータに依存するため、場合によっては検証が困難です。しかし、-1/2乗の「-1/2」という数は他のパラメータによらない数であるので、ソフトマター物理学では、理論の検証のためによく注目されます。そこで、この数を実験的に検証したところ、理論の結果と大差ない結果(-0.49)を得ることができました。この結果は、新生リボソームRNAはDFCのarcRNAとして働くだけではなく、界面活性剤として働くことによって、核小体の海島構造を安定にしていることを示唆しています。
研究成果のポイント
- 核小体の海島型多相構造の形成機構を説明する理論の構築と定量的な検証実験に成功。
- 生成途中のリボソームRNAの発生する表面圧が海島構造形成の原因であることを示唆。
- 核内構造体形成の一般原理と機能を明らかにする研究への波及に期待。
本研究成果が社会に与える影響(本研究成果の意義)
新生リボソームRNAの末端領域が伸びた状態になっているという本研究の結果は、最近の実験結果をよく説明しますが、これまでのリボソームRNAの形成過程の考え方とは異なります。本研究で構築した理論の一番重要な点は、本研究で実施した実験によって定量的に検証することができましたが、この理論の正当性を確かめるためには、さらなる実験的検証が必要だと考えています。転写を抑制すると構造が変化するような核内の構造体は、他にもいくつか知られています。本研究の結果が他の核内構造体に一般化できるのではないかと考えており、核内構造体の形成の一般原理と機能を解明するための研究に波及することを期待しています。分子生物学とソフトマター物理学の融合研究は、そのためのパワフルなアプローチになると考えています。
特記事項
本研究成果は、2023年11月7日(火)公開のCommunications Biology誌に掲載されました。
なお、本研究は、文部科学省科学研究費補助金新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」(21H00241、21H00253)、学術変革領域研究A「DNAの物性から理解するゲノムモダリティ」(20H05934)、新学術領域研究「非ゲノム情報複製」(20H05377)、学術変革領域研究A「非ドメイン型バイオポリマーの生物学」(21H05276)、基盤研究A(20H00448)、基盤研究B(22H02545)、基盤研究C(19K06478、21K03479、22K06083)、 科学技術振興機構(JST)さきがけ(JPMJPR18KA)、CREST(JPMJCR20E6)、持田記念医学薬学振興財団、内藤記念科学振興財団、武田科学振興財団の助成を受けたものです。
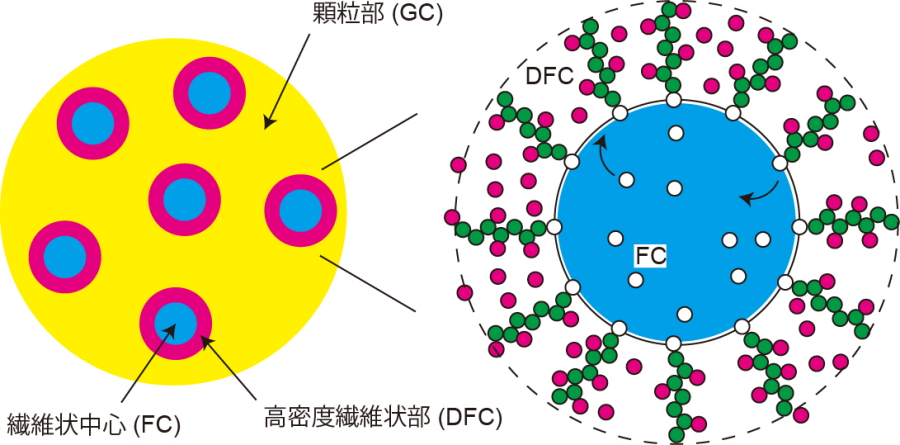
図1.核小体の多相構造
用語解説
- 核小体
タンパク質の合成に必要なリボソームを生成する核内構造体。 - 転写
DNAの遺伝子に対応する塩基配列を持つRNAを生成するプロセス。リボソームRNAは、RNAポリメラーゼIによって合成される。 - 新生リボソームRNA
まだRNAポリメラーゼIに結合している、生成途中のリボソームRNA。 - ソフトマター物理学
高分子、コロイド、液晶などの構造、運動、物性を明らかにし、その共通原理を究明する物理学の分野。 - 核内構造体
核内のDNAの間の空間に存在する、タンパク質とRNAを主成分とする構造体。 - 液液相分離
水と油を混ぜ合わせようとしても、水の領域と油の領域に分離してしまうように、系が異なる成分を持つ液体に分かれてしまう現象。 - リボソームRNA
リボソームの骨格となるRNA。 - arcRNA(アークRNA)
核内構造体形成の足場という機能を持つRNA。 - マイクロエマルション
界面活性剤が水と油の界面に局在化することによって安定化した、水中の油の液滴(また、油中の水の液滴)。
| 原著論文 | Commun. Biol. 6(1):1129 (2023) |
|---|---|
| 論文タイトル | Nascent ribosomal RNA act as surfactant that suppresses growth of fibrillar centers in nucleolus |
| 著者 | Tetsuya Yamamoto (1, 2), Tomohiro Yamazaki (3), Kensuke Ninomiya (3), Tetsuro Hirose (3, 4)
|
| PubMed | 37935838 |
