膜を持たないオルガネラが混じり合わずに存在できるしくみを解明
| 原著論文 | Nat. Cell Biol. (2023) |
|---|---|
| 論文タイトル | Shell protein composition specified by the lncRNA NEAT1 domains dictates the formation of paraspeckles as membraneless organelles |
| 研究室サイト | RNA生体機能研究室〈廣瀬 哲郎 教授〉 |
概要
大阪大学大学院生命機能研究科の高桑央特任研究員(北海道大学医学研究院博士課程)、山崎智弘特任講師(常勤)、廣瀬哲郎教授(大学院理学研究科、先導的学際研究機構兼任)の研究グループは、核内の非膜オルガネラがお互いに独立して存在するための分子メカニズムを明らかにしました。
細胞内に数多く存在する様々な非膜オルガネラは、膜を持たないにもかかわらず、お互いに混じり合うことなく独立して存在しており、このことが固有の機能を果たすために必要です。しかし個々の非膜オルガネラが独立して存在できるメカニズムについてはよくわかっていませんでした。
今回、山崎特任講師(常勤)と廣瀬教授らの研究グループは、核内の非膜オルガネラの一種であるパラスペックルと核スペックルをモデルとして、お互いが独立して存在するしくみの解明を試みました。その結果、パラスペックル表面のタンパク質の組成が非膜オルガネラ同士の融合と分離に関わり、オルガネラの独立性を調節していることを明らかにしました(図1)。これにより、細胞内に多数存在する非膜オルガネラが独立して正しく機能を果たす分子基盤の理解が進み、細胞内相分離による細胞機能制御メカニズムの解明が一層進むことが期待されます。
研究の背景
これまで、細胞内には、多様な非膜オルガネラと呼ばれる膜を持たない液状の構造体が存在することが知られていました。こうした非膜オルガネラは、相分離と呼ばれる物理現象により形成されます。しかし、非膜オルガネラが膜で隔たれた構造を持たないにも関わらず、なぜお互いに混じり合わず、それぞれが固有の状態と機能を維持することができるかはほとんど明らかになっていませんでした。
本研究の成果
山崎特任講師(常勤)と廣瀬教授らの研究グループは、核内の非膜オルガネラの一種であるパラスペックルとその近傍に形成される別の非膜オルガネラである核スペックルをモデルとして、なぜこの2つの非膜オルガネラが独立して存在できるのかについて研究を行いました。パラスペックルは、NEAT1_2と呼ばれる長鎖ノンコーディングRNA(lncRNA)を足場として形成される非膜オルガネラであり、NEAT1_2 lncRNAが周囲から特定のタンパク質を集める設計図として働き、それらのタンパク質を非膜オルガネラの適材適所に配置して構造の構築を行います。こうして構築されたパラスペックルは、表面のシェルと内側のコアの組成が異なるミセルとしての球状、あるいは円筒状の構造体となります。
今回の研究で、このパラスペックルのシェル(表面)を形成するタンパク質の組成が、非膜オルガネラ同士の独立性を決める上で重要な役割を担っていることを明らかにしました。例えば、このタンパク質組成を人為的に崩すと、非膜オルガネラの独立性が維持できなくなり、パラスペックルは別の非膜オルガネラである核スペックルの内部に取り込まれてしまうことも見出しました(図1)。これらの結果は、非膜オルガネラの形成や機能における、界面の重要性に光を当てる基盤的な成果であると考えられます。
研究成果のポイント
- 細胞内相分離により形成される膜のないオルガネラ(非膜オルガネラ)が互いに混じりあわずに、独立して存在するためのしくみを解明
- これまで細胞内に多数同居する非膜オルガネラ同士の独立性を解析する実験系がなかったが、今回人為的に作り出した変異型オルガネラを用い、世界に先駆けて隣接する2つの非膜オルガネラの位置関係を解析することが可能に
- 相分離という様々な生理現象や疾患に関わる基盤的現象の理解と制御に期待
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は、2023年11月7日(火)午前1時(日本時間)に英国科学誌「Nature Cell Biology」(オンライン)に掲載されました。
なお、本研究は、JST戦略的創造研究推進事業(CREST)「細胞内現象の時空間ダイナミクス」研究領域 研究課題名「RNAによる非膜性構造体の形成と作動原理の確立」(課題番号:JPMJCR20E6 研究代表者:廣瀬哲郎)をはじめとし、日本学術振興会科学研究費補助金、日本学術振興会科学研究費助成事業新学術領域研究「クロマチン潜在能」、学術変革領域(A)「非ドメイン生物学」、AMED次世代治療・診断実現のための創薬基盤技術開発事業(RNA標的創薬技術開発)の一環として行われ、フランス国立科学研究センターのGerard Pierron博士、国立がん研究センター研究所の足達俊吾博士、北海道大学大学院薬学研究院の中川真一教授、北海道大学化学反応創成研究拠点の山本哲也博士の協力を得て行われました。
本研究成果は、まだ多くの謎が残されている細胞内相分離現象や、同様に謎が多いlncRNAの働き方を理解するという二重の観点での重要な発見であると考えられます。細胞内相分離やlncRNAは様々な生理現象や疾患の発症に深く関わっていることから、こうした基盤的メカニズムから派生した新たな疾患や創薬研究に関する重要知見が生まれることが期待されます。研究者のコメント
この研究に登場するNEAT1は、別名アーキテクチュラルRNAとも呼ばれ、細胞内構造形成の設計図として働きます。今回、このRNAがオルガネラの独立性を維持するための表面構造を設計図の中に潜ませていたことが明らかになり、その念の入りように驚かされます。(廣瀬哲郎)
特記事項
本研究成果は、2023年11月7日(火)午前1時(日本時間)に英国科学誌「Nature Cell Biology」(オンライン)に掲載されました。
なお、本研究は、JST戦略的創造研究推進事業(CREST)「細胞内現象の時空間ダイナミクス」研究領域 研究課題名「RNAによる非膜性構造体の形成と作動原理の確立」(課題番号:JPMJCR20E6 研究代表者:廣瀬哲郎)をはじめとし、日本学術振興会科学研究費補助金、日本学術振興会科学研究費助成事業新学術領域研究「クロマチン潜在能」、学術変革領域(A)「非ドメイン生物学」、AMED次世代治療・診断実現のための創薬基盤技術開発事業(RNA標的創薬技術開発)の一環として行われ、フランス国立科学研究センターのGerard Pierron博士、国立がん研究センター研究所の足達俊吾博士、北海道大学大学院薬学研究院の中川真一教授、北海道大学化学反応創成研究拠点の山本哲也博士の協力を得て行われました。
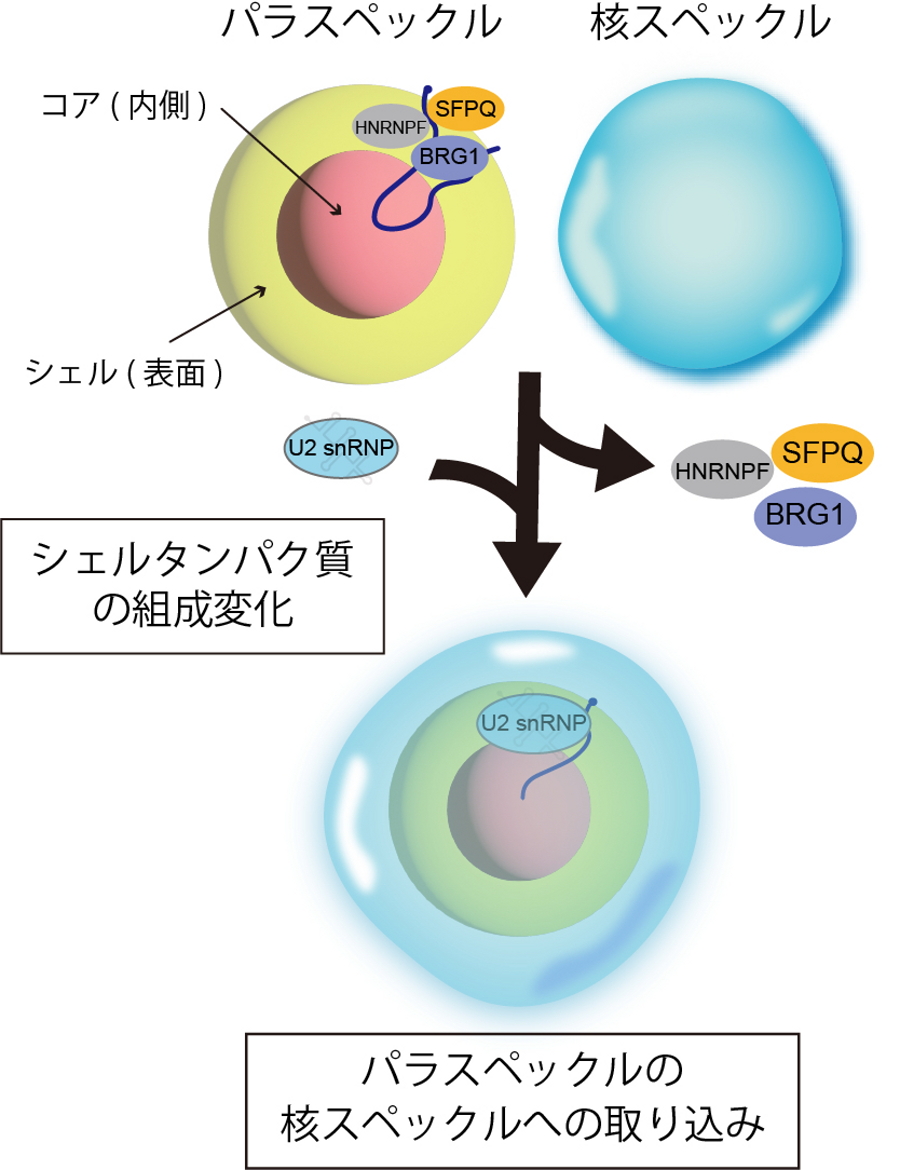
図1.
パラスペックル表面のタンパク質組成が、核スペックルと混じり合わずに独立に存在させる機構を担っている。この組成に異常が生じると、パラスペックルは核スペックル内に取り込まれてしまいます。
用語解説
- 非膜オルガネラ
脂質膜に覆われず、細胞内で特定の分子群を集約している構造体。脂質膜に覆われ形成される細胞小器官(オルガネラ)との対比でこのように呼ばれる。混み合った細胞内空間で特定の分子を集めた細胞内区画を作ることは、多数の生体分子を効率的かつ精密に制御するために生命機能の根幹をなすメカニズムである。 - パラスペックル
NEAT1 lncRNAを骨格とする核内非膜オルガネラで、RNAやタンパク質の係留を介した遺伝子発現の調節を行っている。またがんや神経変性疾患などの発症への関与も知られている。 - 核スペックル
RNAの成熟に関わる因子の集積する非膜オルガネラで、遺伝子発現と密接な関連を持つ。 - 細胞内相分離
特定の分子が集まり、液体・固体・ゲルなどといった状態で濃度の異なる分離した相を作る物理現象を相分離という。細胞内では、この相分離現象が広範に起こっており、生命活動に必須の役割を持つことが分かりつつある。また、疾患との関連でも重要な現象であり、注目を集めている。 - 長鎖ノンコーディングRNA(lncRNA)
ゲノムから多数産生される、200塩基以上の長さを持つタンパク質情報を持たないRNAの総称。タンパク質を作る情報を持つmRNAとは異なり、RNA分子自体が遺伝子発現制御や細胞内構造形成などの多様な機能を持ち、様々な生理現象や疾患に関わっている。 - ミセル
水になじみやすい(親水性)部分となじみにくい(疎水性)部分を持つ分子が、水の中で疎水性部分を内側にして球状などの構造として集まったもの。構造の中心部は疎水性、周辺部は親水性という性質を持っている。
| 原著論文 | Nat. Cell Biol. (2023) |
|---|---|
| 論文タイトル | Shell protein composition specified by the lncRNA NEAT1 domains dictates the formation of paraspeckles as membraneless organelles |
| 著者 | Hiro Takakuwa (1, 2), Tomohiro Yamazaki (1), Sylvie Souquere (3), Shungo Adachi (4), Hyura Yoshino (2), Naoko Fujiwara (1), Tetsuya Yamamoto (5), Tohru Natsume (6), Shinichi Nakagawa (7), Gerard Pierron (8), Tetsuro Hirose (1, 9)
|
