傷ついたリソソームを修復する新たなメカニズムを発見
リソソーム損傷を伴う結晶性腎症などへの新規治療法開発に期待
| 原著論文 | Nat. Cell Biol. 22(10):1252-1263 (2020) |
|---|---|
| 研究室サイト | 細胞内膜動態研究室 |
概要
中村修平准教授(大阪大学大学院医学系研究科/生命機能研究科/高等共創研究院)、南聡特任助教(常勤)(医学系研究科)、重山紗紀さん(生命機能研究科の大学院生、当時:博士前期課程)、吉森保教授(医学系研究科遺伝学/生命機能研究科細胞内膜動態研究室)らの研究グループは、リソソームに傷がついた際にこれを修復する全く新しいメカニズムを明らかにしました(図1)。
リソソームは細胞内外から取り込まれた様々な物質の分解を行う細胞内小器官です。シュウ酸カルシウムなどの様々な刺激性微粒子は細胞内に取り込まれた後、リソソームを傷つけることが知られています。リソソームが損傷を受けると、酸性の内容物が細胞質へ出てしまい、細胞にとって有害となります。これまでに、研究グループは細胞内分解システムとして知られるオートファジーが傷ついたリソソームを選択的に隔離、修復すること(リソファジー)を見いだしています。
今回、研究グループは、リソファジーに加えて、オートファジーやリソソーム生合成を制御するTFEBの働きによっても傷ついたリソソームが修復されることを見いだしました。さらに、マウスやヒト検体を用いた解析から、この新しいメカニズムは、シュウ酸カルシウム結晶などが腎臓の尿細管に蓄積し、リソソームの障害を伴って発症することが知られている結晶性腎症の病態悪化を防ぐ重要な防御機構であることが分かりました。今回の発見は、結晶性腎症をはじめ、リソソームに傷がつくことで悪化する病気の治療への応用が期待されます。
研究の背景
これまでリソソームは細胞内外の様々な結晶によって傷つくことが知られていました。リソソームが傷つくと、リソソーム内にある酸性の内容物が細胞質に出てしまいます。リソソームから出た内容物は、炎症、酸化ストレスを引き起こし、細胞死につながるため、有害です。特に腎臓では結晶(ある種の薬剤、腎結石の原因となるシュウ酸カルシウム結晶や尿酸結晶など)の取り込み能が高いため、これらの結晶にさらされるとリソソームが傷つき、結晶性腎症と呼ばれる腎傷害が生じることが知られています。これまで細胞がリソソーム障害にどのように対処しているかはよく分かっていませんでしたが、研究グループは細胞内分解システムとして知られるオートファジーが傷ついたリソソームを選択的に隔離、修復することを見いだし、リソファジーと名付けました(Maejima et al., EMBO J, 2013)(図1)。一方で、オートファジー・リソソーム生合成を制御する転写因子TFEBがこの傷ついたリソソームの修復に関与することが予測されていましたが、そのメカニズムや役割、またリソファジーとの関連はよく分かっていませんでした。
本研究の成果
研究グループは、TFEBがリソソームに傷がついた際に活性化し、このことが傷ついたリソソームの修復に必須であることを見いだしました。さらに、このTFEB活性化メカニズムも明らかにしました。TFEBの活性化には、脂質化されたLC3の働きが必要であるという予想外の発見をしました(図2)。LC3は、オートファジーが誘導されると脂質化されてオートファゴソームに局在するタンパク質であることが本研究グループによって明らかにされています(Kabeya et al., EMBO J, 2000)。しかしながら、今回リソソームが傷ついた際に脂質化LC3はオートファゴソームだけでなく、リソソームにも局在することを見いだしました。脂質化LC3は、オートファジー(リソファジー)における機能とは独立して、リソソーム上のカルシウムチャネルTRPML1と相互作用し、リソソームからのカルシウム流出を促すことで、TFEBを活性化することが示唆されました。また、TFEBを欠損したマウスでは欠損していないマウスと比較すると傷ついたリソソームが多く見られ、腎症が悪化していました(図3)。このLC3による新規TFEB活性化メカニズムがリソソーム障害を伴う結晶性腎症の悪化を防いでいることが分かりました。
研究成果のポイント
- 細胞内外から様々な物質を取り込んで細胞内消化するリソソームは、シュウ酸カルシウムなどの様々な刺激性微粒子により傷つくことが知られており、これを修復する新たなメカニズムを発見。
- 傷ついたリソソームの修復には、オートファジーやリソソーム生合成を制御する転写因子TFEB(transcription factor EB)が活性化することが必須であることを明らかにした。
- 結晶性腎症を始め、リソソーム損傷を伴う病気の治療法への応用が期待される。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、細胞が傷ついたリソソームをどのように修復しているかを明らかにすることで、細胞の理解を進めました。また、本研究成果は結晶性腎症に限らずリソソーム損傷を伴う多くの病気の治療に応用できる可能性があると考えられます。また、リソソーム上のカルシウムチャネルTRPML1はムコリピドーシスIV型と呼ばれるリソソーム病の原因遺伝子として知られており、このTRPML1の人為的活性化はTFEB活性化を介したリソソーム機能亢進やオートファジーの活性化を通して、リソソーム病や神経変性疾患を含む多くの病態改善に寄与することが分かっています。そのため、世界中でTRPML1のアゴニスト探索が盛んに行われています。LC3がTRPML1と相互作用しTFEBの活性を調節し得るという今回の発見が、今後効果的なアゴニストの探索にも役立つことが期待されます。
特記事項
本研究成果は、国際科学誌「Nature Cell Biology」に、9月29日(火)午前0時(日本時間)に公開されました。
なお、本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST研究領域「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」における研究課題「オートファジーによる細胞外微粒子応答と形成」(研究代表者:吉森保)「JPMJCR17H6」、JSPS若手研究A「リソソーム損傷時のオートファジー因子によるTFEB新規制御機構とその生理学的意義研究」(中村修平)「17H05064」の一環として行われました。
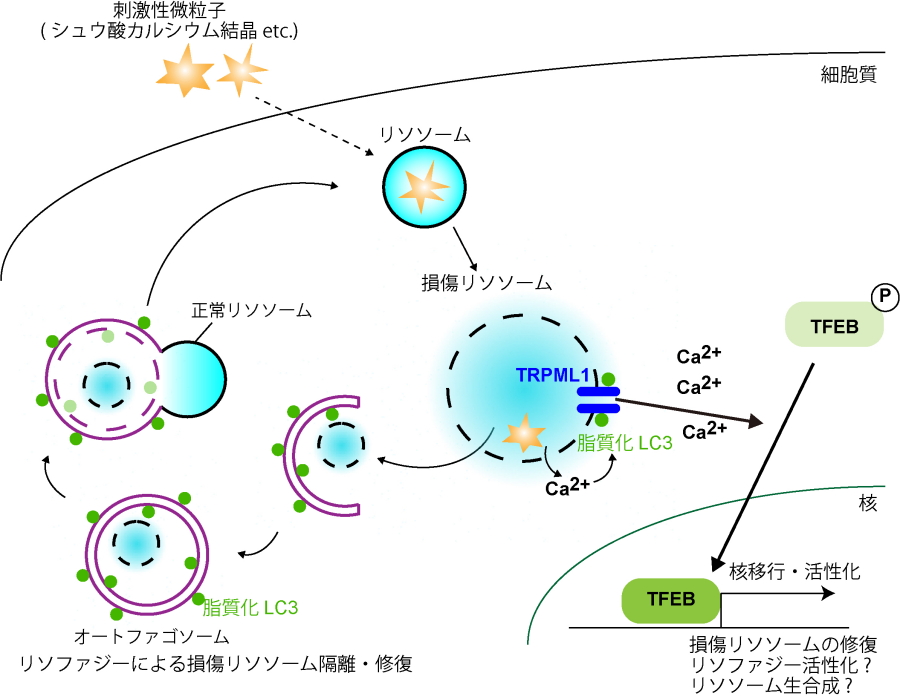
図1.
研究成果概略リソソームが傷つくと、脂質化LC3がリソソーム上のカルシウムチャネルTRPML1と相互作用しリソソームからのカルシウム流出を促し、これがTFEBの活性化につながる。
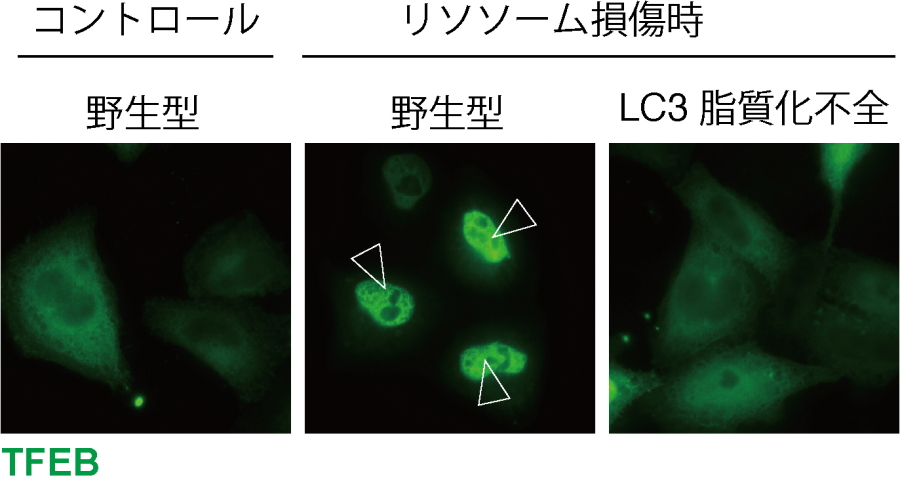
図2.脂質化LC3がTFEB活性化に必要である
野生型の細胞ではリソソーム損傷時にTFEBが核移行、活性化するが、LC3脂質化が起きない細胞ではこれが起こらない。
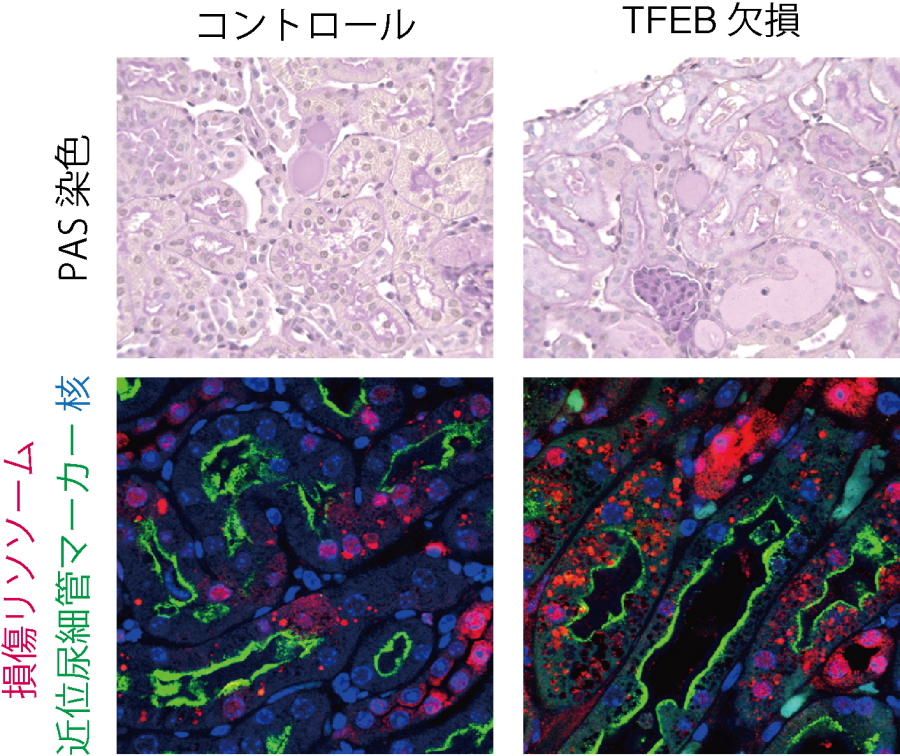
図3.TFEBの働きが結晶性腎症悪化を防ぐ
結晶性腎症(シュウ酸カルシウム腎症)のモデルマウスの腎臓組織像(上)と腎臓組織免疫染色像(下)。TFEBを欠損したマウスの腎臓では、損傷リソソーム(右下、赤)がより多く見られ、腎症が悪化する(右上)。赤:損傷リソソーム、緑:近位尿細管マーカー、青:核
用語解説
- オートファジー
細胞が持つ自己分解経路であり、栄養飢餓などにより引き起こされる。分解対象をオートファゴソームと呼ばれる脂質二重膜で隔離し、リソソームと融合させる。その後、リソソーム内の加水分解酵素により内容物を消化する。 - TFEB(転写因子EB:transcription factor EB)
リソソーム生合成やオートファジーに関連したタンパク質の遺伝子発現を活性化する転写因子。 - 結晶性腎症
薬剤結晶やシュウ酸カルシウム結晶や尿酸結晶をはじめとする、結晶に暴露されて生じる腎傷害。 - ムコリピドーシスIV型
TRPML1遺伝子の変異によって引き起こされる常染色体劣性遺伝性のリソソーム蓄積症の一種。精神運動発達遅滞と視覚障害を臨床的な特徴とする。 - アゴニスト
生体内において、ホルモンなどの生理活性物質の受容体に結合し、その生理活性物質が引き起こす作用と同様または類似の作用を持つ薬のこと。
| 原著論文 | Nat. Cell Biol. 22(10):1252-1263 (2020) |
|---|---|
| 著者 | Shuhei Nakamura (1, 2, 3), Saki Shigeyama (1, 2), Satoshi Minami (4), Takayuki Shima (1, 2), Shiori Akayama (1, 2), Tomoki Matsuda (5), Alessandra Esposito (6), Gennaro Napolitano (6, 7), Akiko Kuma (1, 2), Tomoko Namba-Hamano (4), Jun Nakamura (4), Kenichi Yamamoto (8), Miwa Sasai (9, 10), Ayaka Tokumura (1, 2), Mika Miyamoto (1, 2), Yukako Oe (1, 2), Toshiharu Fujita (1, 2), Seigo Terawaki (11), Atsushi Takahashi (4), Maho Hamasaki (1, 2), Masahiro Yamamoto (9, 10), Yukinori Okada (8), Masaaki Komatsu (12), Takeharu Nagai (5), Yoshitsugu Takabatake (4), Haoxing Xu (13), Yoshitaka Isaka (4), Andrea Ballabio (6, 7, 14, 15, 16), Tamotsu Yoshimori (1, 2, 17)
|
| PubMed | 32989250 |
