化学平衡論
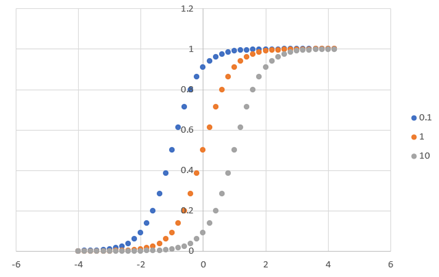
基質の結合曲線,リニア vs. 対数表示
[L]=Kの時の傾きは,
リニア表示の場合,
\( \Large \displaystyle \left. \frac{d \ P_B}{dL} \right|_{[L]=K} = \frac{K}{(K +K)^2 } = \frac{1}{4K}\)
とKに依存します.
対数表示の場合は,
\( \Large \displaystyle \left. \frac{d \ P_B}{dL} \right|_{[L]= K} = \frac{2.3}{4} = \frac{1}{ 4 \ log (e)} = 0.575 \)
とKに依存しないことがわかります.
これら両者の関係は,
\( \Large \displaystyle \left. \frac{d \ P_B}{dL} \right|_{[L]=K} = \left. \frac{d \ P_B}{d \ log \ L} \frac{d \ log \ L} {L} \right|_{[L]=K}
= \left. \frac{d \ P_B}{d \ log \ L} \right|_{[L]=K} \left. \frac{d \ log \ L} {L} \right|_{[L]=K}\)
となります.
\( \Large \displaystyle \left. \frac{d \ log \ L} {L} \right|_{[L]=K}\)
ですが,
\( \Large \displaystyle log \ L = y \rightarrow L = 10^y \rightarrow ln \ L =ln \ 10^y = y \cdot ln 10 = \frac{ln L}{2.3} \)
なので,
\( \Large \displaystyle \left. \frac{d \ log \ L} {L} \right|_{[L]=K} =\frac{1}{2.3} \left. \frac{d \ ln \ L} {L} \right|_{[L]=K} = \frac{1}{2.3 K} \)
となるので,
\( \Large \displaystyle \left. \frac{d \ P_B}{dL} \right|_{[L]=K} = \left. \frac{d \ P_B}{d \ log \ L} \right|_{[L]=K} \frac{1}{2.3 K} \)
となり,それぞれ,
\( \Large \displaystyle \frac{1}{4K} = \frac{2.3}{4} \frac{1}{2.3 K} \)
となり,一致することがわかります.
対数表示にすると,

環境が変化すると,解離定数Kが変わったときに,カーブがシフトすることからわかりやすくなりますね.
しかし,横軸の基質濃度が対数なので,
幅広い濃度域での実験
が必要となり,さらに,
変曲点での濃度域での実験
が必要となります.
ちなみに,1~10の濃度範囲(mMでもμMでもなんでも)では,
| log C | 0.0 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| C | 1.00 | 1.26 | 1.58 | 2.00 | 2.51 | 3.16 | 3.98 | 5.01 | 6.31 | 7.94 | 10.0 |
と1~4の範囲を重点的に実験することが必要となります.